VFEND
PFIZER
Comprimidos recubiertos
Antimicótico sistémico.
Composición.
50 mg: Cada comprimido recubierto contiene: Voriconazol 50 mg. Lactosa monohidrato 62,50 mg. Almidón pregelatinizado 21,00 mg. Croscarmelosa sódica 7,5 mg. Povidona 7,5 mg. Estearato de magnesio 1,5 mg. Opadry blanco 3,75 mg. 200 mg: Cada comprimido recubierto contiene: Voriconazol 200 mg. Lactosa monohidrato 250 mg. Almidón pregelatinizado 84 mg. Croscarmelosa sódica 30 mg. Povidona 30 mg. Estearato de magnesio 6 mg. Opadry blanco 15 mg.
Farmacología.
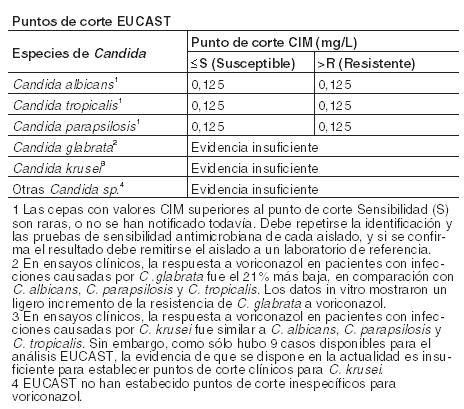
Propiedades Farmacodinámicas: Grupo farmacoterapéutico: Código ATC: J02A C03. Antimicóticos de uso sistémico, derivados triazólicos. Mecanismo de acción: Voriconazol muestra un amplio espectro de actividad in vitro, con actividad antifúngica frente a especies de Candida (incluyendo C. krusei resistente a fluconazol y cepas resistentes de C. glabrata y C. albicans) y una actividad fungicida frente a todas las especies de Aspergillus estudiadas. Además, voriconazol muestra actividad fungicida in vitro frente a patógenos fúngicos emergentes, incluyendo aquellos como Scedosporium o Fusarium de sensibilidad limitada a los fármacos antifúngicos existentes. Su mecanismo de acción es la inhibición de la 14 a-esterol desmetilasa fúngica dependiente del citocromo P450, una enzima esencial en la biosíntesis del ergosterol. Microbiología: Se ha demostrado eficacia clínica, definida como respuesta completa o parcial frente a Aspergillus spp., incluyendo A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans; Candida spp., incluyendo C. albicans, C. glabrata, C. krusei, C. parapsilosis y C. tropicalis y frente a un número limitado de C. dubliniensis, C. inconspicua y C. guilliermondii; Scedosporium spp., incluyendo S. apiospermum, S. prolificans y Fusarium spp. Otras infecciones micóticas tratadas (a menudo, con respuesta parcial o completa), incluyeron casos aislados producidos por Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., incluyendo P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis y Trichosporon spp, incluyendo infecciones por T. beigelii. Se ha observado actividad in vitro frente a muestras clínicas de Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp. e Histoplasma capsulatum, siendo inhibidas la mayoría de las cepas por concentraciones de voriconazol entre 0,05 y 2 mg/ml. Se ha demostrado actividad in vitro frente a los patógenos siguientes, si bien se desconoce el significado clínico: Curvularia spp., y Sporothrix spp. Deben obtenerse muestras para cultivo de hongos y otros estudios de laboratorio relevantes (serología, histopatología) antes de comenzar el tratamiento, con el fin de aislar e identificar el microorganismo causal. Puede instaurarse el tratamiento antes de disponer del resultado de los cultivos y de los otros estudios de laboratorio pero, una vez que se disponga de estos resultados, el tratamiento antiinfeccioso debe ajustarse de acuerdo con ellos. Las especies que están implicadas más frecuentemente en infecciones humanas incluyen C. albicans, C. parapsilosis, C. tropicalis, C. glabrata y C. krusei, todas ellas especies que normalmente muestran concentraciones mínimas inhibitorias (CMIs) menores de 1 mg/l para voriconazol. Sin embargo, la actividad in vitro de voriconazol frente a especies de Candida no es uniforme. Específicamente, para C. glabrata, las CIMs de voriconazol para aislados resistentes a fluconazol son proporcionalmente más altas que las correspondientes a las de aislados sensibles a fluconazol. Por tanto, se deben realizar todos los esfuerzos posibles para identificar la especie de Candida. Si se dispone del test de sensibilidad antifúngico, la CIM resultante debe interpretarse utilizando los criterios de los puntos de corte establecidos por el Comité Europeo de Ensayos de Susceptibilidad a Antimicrobianos (EUCAST).
Experiencia clínica: En este apartado se define el resultado satisfactorio como respuesta completa o parcial. Infecciones por Aspergillus - eficacia en pacientes con aspergilosis de mal pronóstico: Voriconazol presenta actividad fungicida in vitro frente a Aspergillus spp. Se demostró la eficacia y beneficio de voriconazol en la supervivencia frente a anfotericina B convencional en el tratamiento primario de la aspergilosis invasiva aguda, en un estudio abierto, randomizado y multicéntrico en 277 pacientes inmunodeprimidos tratados durante 12 semanas. Se observó una respuesta global satisfactoria (resolución completa o parcial de todos los síntomas y signos atribuibles, alteraciones radiográficas/broncoscópicas presentes al inicio del tratamiento) en el 53% de los pacientes tratados con voriconazol frente al 31% en pacientes tratados con el fármaco comparativo. La tasa de supervivencia con voriconazol en el día 84 fue superior en forma estadísticamente significativa a la obtenida con el fármaco comparativo y se demostró un beneficio estadística y clínicamente significativo a favor de voriconazol, tanto con relación al tiempo hasta el fallecimiento como al momento de abandono debido a la toxicidad. Este estudio confirmó hallazgos de un estudio anterior, diseñado prospectivamente en donde se obtuvo un resultado positivo en los pacientes con factores de riesgo de mala evolución, incluyendo enfermedad injerto contra huésped y, en particular, infecciones cerebrales (asociadas normalmente con una mortalidad de casi el 100%). Los estudios incluyeron aspergilosis cerebral, sinusal, pulmonar y diseminada en pacientes con transplante de médula ósea y de órganos sólidos, neoplasias hematológicas, cáncer y SIDA. Candidemia en pacientes no neutropénicos y otras infecciones por Candida en tejidos profundos: Se comparó voriconazol con el régimen de anfotericina B seguido por fluconazol en un estudio abierto y comparativo realizado en pacientes no neutropénicos con candidemia asociada a los signos clínicos de infección (Estudio 608). Los pacientes fueron randomizados en una relación 2:1 a grupos que recibieron voriconazol (n = 283) o el régimen de anfotericina B seguido por fluconazol (n = 139). Los pacientes fueron tratados con la droga de estudio randomizada durante una mediana de 15 días. En la evaluación de eficacia, la mayoría de los casos de candidemia fue causada por C. Albicans (46%), seguida por C. tropicalis (19%), C. parapsilosis (17%), C. glabrata (15%) y C. krusei (1%). Un Comité de revisión de datos (DRC) independiente, cegado para el tratamiento de estudio, revisó los datos micológicos y clínicos obtenidos a partir de este estudio y produjo una evaluación de la respuesta para cada paciente. Para una respuesta exitosa se requiere que el paciente presente todas las condiciones que se describen a continuación: remisión por mejoría de todos los signos clínicos y síntomas de infección, cultivos de sangre con resultado negativo para Candida, áreas de tejido profundo infectado con resultado negativo para Candida o remisión de todos los signos de infección sin terapia antifúngica sistémica distinta de la droga del estudio. El análisis primario, que incluyó los éxitos evaluados por el DRC en un momento determinado [12 semanas después de la Finalización del tratamiento (FT)], demostró que voriconazol fue comparable con el régimen de anfotericina B seguido por fluconazol (índices de respuesta del 41% y 41%, respectivamente) para el tratamiento de la candidemia. Los pacientes que por cualquier motivo no fueron evaluados durante 12 semanas, fueron considerados fracasos del tratamiento. En la siguiente Tabla se presentan los índices generales de éxito micológico y clínico del Estudio 608, por la especie Candida:
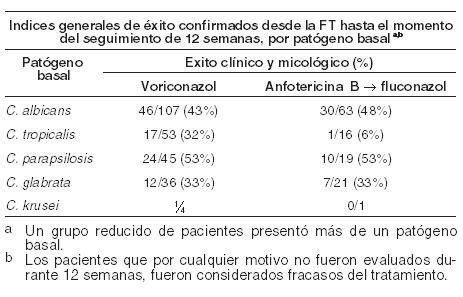
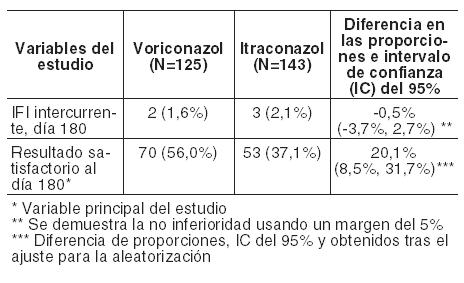
En un análisis secundario, que incluyó la evaluación del DRC en cualquier momento (FT, o 2, 6 ó 12 semanas después de la FT), los índices de respuesta fueron del 65% para voriconazol y del 71% para el régimen de anfotericina B seguido por fluconazol. En los Estudios 608 y 309/604 (estudio no comparativo realizado en pacientes con infecciones fúngicas invasivas que presentaron resistencia o intolerancia a otros agentes antifúngicos), se evaluó voriconazol en 35 pacientes con infecciones por Candida en el tejido profundo. Se observó una respuesta favorable en 4 de 7 pacientes con infecciones intraabdominales, 5 de 6 pacientes con infecciones en la pared de la vejiga y el riñón, 3 de 3 pacientes con infección de heridas o abscesos en tejido profundo, 1 de 2 pacientes con infecciones del espacio pleural/neumonía, 2 de 4 pacientes con lesiones cutáneas, 1 de 1 paciente con infección mixta intraabdominal y pulmonar, 1 de 2 pacientes con flebitis supurativa, 1 de 3 pacientes con infección hepatoesplénica, 1 de 5 pacientes con osteomielitis, 0 de 1 con infección hepática y 0 de 1 con infección del nódulo linfático cervical. Infecciones refractarias graves por Candida: El estudio incluyó a 55 pacientes con infecciones sistemáticas refractarias graves por Candida (incluyendo candidemia, candidiasis diseminada y otras candidiasis invasivas) en las que el tratamiento antifúngico previo, en particular con fluconazol, fue ineficaz. Se observaron resultados favorables en 24 pacientes (15 respuestas completas y 9 respuestas parciales). En especies no albicans resistentes al fluconazol se observó un resultado favorable en 3/3 en el caso de infecciones por C. krusei (respuestas completas) y en 6/8 en el caso de infecciones por C. glabrata (5 respuestas completas, 1 respuesta parcial). Los datos de eficacia clínica estaban apoyados por datos limitados de sensibilidad. Infecciones por Scedosporium y Fusarium: Se ha demostrado que voriconazol es eficaz frente a los siguientes patógenos fúngicos poco frecuentes: Scedosporium spp.: Se observó una respuesta favorable a voriconazol en 16 (6 respuestas completas, 10 respuestas parciales) de 28 pacientes con infección por S. apiospermum y en 2 (ambas respuestas parciales) de 7 pacientes con infección por S. prolificans. Además, se observó una respuesta satisfactoria en 1 de 3 pacientes con infecciones causadas por más de un microorganismo incluyendo Scedosporium spp. Fusarium spp.: El tratamiento con voriconazol tuvo éxito en 7 (3 respuestas completas, 4 respuestas parciales) de 17 pacientes. De estos 7 pacientes, 3 presentaron infecciones oculares, 1 sinusal y 3 diseminadas. Otros 4 pacientes adicionales con fusariosis padecían una infección por varios microorganismos y en 2 de ellos el resultado fue favorable. La mayoría de los pacientes que recibían tratamiento con voriconazol para las infecciones raras mencionadas anteriormente habían sido intolerantes o refractarios a tratamientos antifúngicos previos. Profilaxis primaria de infecciones fúngicas invasivas: eficacia en receptores de TCMH sin infección fúngica invasiva (IFI) probada o probable previa: Voriconazol se comparó con itraconazol como profilaxis primaria en un estudio abierto, comparativo, multicéntrico, en adultos y adolescentes receptores de TCMH alogénico sin IFI probada o probable previa. El resultado satisfactorio se definió como la capacidad para mantener la profilaxis con el fármaco del estudio durante 100 días tras el TCMH (sin interrupción durante > 14 días) y la supervivencia sin IFI probada o probable durante 180 días tras el TCMH. El grupo por intención de tratar modificado (IDTm) estaba compuesto por 465 receptores de un TCMH alogénico, el 45% de los cuales padecía leucemia mieloide aguda (LMA). El 58% del total de pacientes estaba sometido a un régimen mielosupresor. La profilaxis con el fármaco del estudio se inició inmediatamente después del TCMH: 224 pacientes recibieron voriconazol y 241 recibieron itraconazol. En el análisis por intención de tratar, la mediana de duración de la profilaxis con el fármaco del estudio fue de 96 días en el caso del voriconazol y de 68 días en el caso del itraconazol. En la Tabla siguiente se presentan las tasas de resultado satisfactorio y otras variables secundarias:
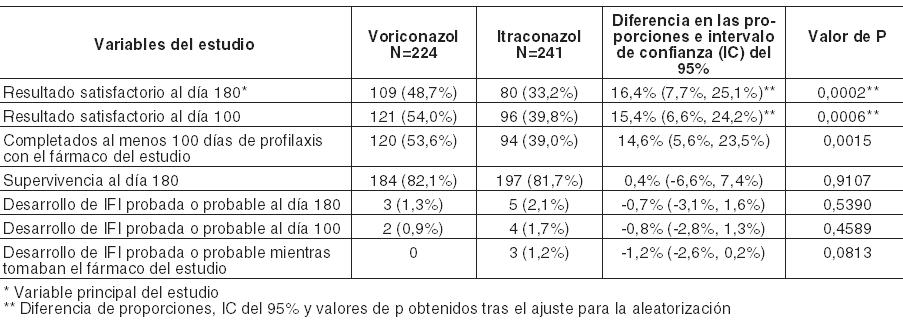
En la Tabla siguiente se presentan el avance de la tasa de IFI al día 180 y la variable principal del estudio (resultado satisfactorio al día 180) para pacientes con LMA y regímenes en condiciones mielosupresoras respectivamente:
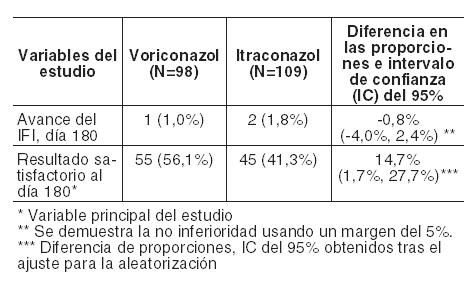
Eficacia de la profilaxis secundaria de IFI en receptores de TCMH con IFI probada o probable previa: Voriconazol se estudió en profilaxis secundaria en un estudio abierto, no comparativo, multicéntrico, en adultos receptores de un TCMH alogénico con IFI probada o probable previa. El punto final primario del estudio fue la tasa de aparición de IFI probada o probable durante el primer año tras el TCMH. El grupo intención de tratar estaba compuesto por 40 pacientes con IFI previa, incluyendo: 31 con aspergilosis, 5 con candidiasis y 4 con otro tipo de IFI. La mediana de duración de la profilaxis con el fármaco del estudio fue de 95,5 días. Durante el primer año posterior al TCMH, el 7,5% de los pacientes (3/40) desarrollaron IFI probada o probable, incluyendo: una candidemia, una scedosporiosis (ambas recidivas de una IFI anterior) y una cigomicosis. La tasa de supervivencia fue del 80,0% (32/40) al día 180 y del 70,0% (28/40) al año. Duración del tratamiento: En los ensayos clínicos, 705 pacientes recibieron tratamiento con voriconazol durante más de 12 semanas y 164 pacientes lo recibieron durante más de 6 meses. Experiencia en pacientes pediátricos: Cincuenta y tres pacientes pediátricos de entre 2 a < 18 años fueron tratados con voriconazol en dos ensayos clínicos prospectivos, de etiqueta abierta, no comparativo, multicéntricos. Un estudio reclutó a 31 pacientes con posible, probada o probable aspergilosis invasiva (AI), de los cuales 14 pacientes habían demostrado o era probable la IA y se incluyeron en los análisis de la eficacia MITT. El segundo estudio incluyó a 22 pacientes con candidiasis invasiva incluyendo candidemia (ICC) y la candidiasis esofágica (CE) que requiere terapia primaria o de rescate, de los cuales 17 se incluyeron en los análisis de la eficacia MITT. Para los pacientes con IA las tasas generales de respuesta global a las 6 semanas fueron 64,3% (9/14), la tasa de respuesta global fue del 40% (05/02) en los pacientes de 2 a < 12 años y el 77,8% (07/09) para los pacientes de 12 a < 18 años de edad. Para los pacientes con ICC la tasa de respuesta global al EOT fue del 85,7% (06/07) y para los pacientes con CE, la tasa de respuesta global al EOT fue del 70% (7/10). La tasa global de respuesta (ICC y EC combinado) fue 88,9% (08/09) de 2 a < 12 años de edad y el 62,5% (05/08) de 12 a < 18 años de edad. Estudios clínicos sobre el intervalo QTc: Se realizó un estudio a dosis únicas, cruzado, aleatorizado y controlado con placebo, con el fin de evaluar el efecto sobre el intervalo QTc en voluntarios sanos, con tres dosis de voriconazol y una de ketoconazol administradas por vía oral. Después de la administración de dosis de 800 mg, 1200 mg y 1600 mg de voriconazol, se obtuvieron unos incrementos máximos medios ajustados a placebo en el QTc desde el inicio, de 5,1; 4,8 y 8,2 mseg, respectivamente, y de 7,0 mseg para una dosis de 800 mg de ketoconazol. De todos los grupos, ningún individuo presentó un incremento en el QTc ≥60 mseg desde el basal. Ningún individuo experimentó un intervalo que excediese el umbral con potencial clínicamente relevante de 500 mseg. Propiedades Farmacocinéticas: Características farmacocinéticas generales: La farmacocinética de voriconazol ha sido descrita en voluntarios sanos, poblaciones especiales y pacientes. Durante la administración oral de 200 mg o 300 mg dos veces al día durante 14 días en pacientes con riesgo de aspergilosis (principalmente pacientes con neoplasias malignas del tejido linfático o hematopoyético), las características farmacocinéticas observadas de absorción rápida y uniforme, acumulación y farmacocinética no lineal concordaron con las observadas en los sujetos sanos. La farmacocinética de voriconazol es no lineal debido a la saturación de su metabolismo. Al aumentar la dosis se obtienen incrementos de la exposición superiores a los proporcionales. Se estima, como media, que el incremento de la dosis por vía oral de 200 mg dos veces al día a 300 mg dos veces al día se traduce en una exposición 2,5 veces mayor (AUCt). Cuando se administran las dosis de carga recomendadas, por vía intravenosa u oral, se alcanzan concentraciones plasmáticas próximas al estado estable en las primeras 24 horas de administración. Cuando no se administra la dosis de carga, se produce acumulación con dosis múltiples, dos veces al día, alcanzándose las concentraciones plasmáticas de voriconazol del estado estable en el Día 6 en la mayoría de los sujetos. Absorción: Voriconazol se absorbe rápida y casi completamente tras la administración oral, alcanzándose concentraciones plasmáticas máximas (Cmáx) en 1-2 horas tras la administración. La biodisponibilidad absoluta de voriconazol tras la administración oral se calcula que es del 96%. Se ha demostrado bioequivalencia entre los comprimidos de 200 mg y la suspensión oral de 40 mg/ml cuando se administra una dosis de carga 400 mg cada 12 horas, seguida de una dosis de mantenimiento de 200 mg cada 12 horas. Cuando se administran dosis múltiples de voriconazol con comidas ricas en grasas la Cmáx y el AUCt se reducen en un 34% y 24%, respectivamente, cuando se administran comprimidos, y en un 58% y 37%, respectivamente, cuando se administran como suspensión oral. La absorción de voriconazol no se ve afectada por los cambios del pH gástrico. Distribución: Se calcula que el volumen de distribución de voriconazol en el estado estable es de 4,6 L/kg, lo que indica una extensa distribución en los tejidos. Se estima que la unión a proteínas plasmáticas es del 58%. Muestras de líquido cefalorraquídeo de 8 pacientes incluidos en un programa de uso compasivo presentaron concentraciones detectables de voriconazol en todos ellos. Metabolismo: Estudios in vitro han demostrado que voriconazol se metaboliza a través de las isoenzimas del citocromo P450 hepático CYP2C19, CYP2C9 y CYP3A4. La variabilidad interindividual de la farmacocinética de voriconazol es alta. Los estudios in vivo indicaron que CYP2C19 participa significativamente en el metabolismo de voriconazol. Esta enzima muestra un polimorfismo genético. Por ejemplo, cabe esperar que el 15-20% de las poblaciones asiáticas sean metabolizadores lentos. En los pacientes de raza caucásica y negra, la prevalencia de metabolizadores lentos es del 3-5%. Los estudios realizados en sujetos sanos de raza caucásica y japoneses han demostrado que los metabolizadores lentos tienen, en promedio, una exposición a voriconazol (AUCt) cuatro veces superior que los metabolizadores rápidos homocigóticos. Los sujetos metabolizadores rápidos heterocigóticos tienen en promedio una exposición dos veces superior a voriconazol que los metabolizadores rápidos homocigóticos. El metabolito principal de voriconazol es el N-óxido, que representa un 72% de los metabolitos radiomarcados circulantes en plasma. Este metabolito presenta una actividad antifúngica mínima que no contribuye a la eficacia global de voriconazol. Excreción: Voriconazol se elimina mediante metabolismo hepático con menos del 2% de la dosis eliminada de forma inalterada en la orina. Tras la administración de una dosis radiomarcada de voriconazol, aproximadamente el 80% de la radioactividad se recupera en orina tras la administración intravenosa de dosis múltiples y el 83% tras la administración oral de dosis múltiples. La mayor parte ( > 94%) de la radioactividad total se excreta en las primeras 96 horas tras la administración tanto oral como intravenosa. La vida media terminal de voriconazol depende de la dosis y es de aproximadamente 6 horas con 200 mg (por vía oral). Debido a la farmacocinética no lineal, la vida media terminal no resulta útil para predecir la acumulación o eliminación de voriconazol. Relación farmacocinética-farmacodinámica: En 10 estudios terapéuticos, la mediana de las concentraciones plasmáticas media y máxima en cada sujeto fue de 2425 ng/ml (rango intercuartil 1193 a 4380 ng/ml) y 3742 ng/ml (rango intercuartil 2027 a 6302 ng/ml), respectivamente. En los estudios terapéuticos no se encontró una asociación positiva entre las concentraciones plasmáticas media, máxima o mínima de voriconazol y la eficacia. Dicha relación no se ha evaluado en los estudios de profilaxis. Los análisis farmacocinéticos-farmacodinámicos de los datos de los ensayos clínicos identificaron asociaciones positivas entre las concentraciones plasmáticas de voriconazol y las alteraciones tanto de las pruebas de función hepática como de la visión. No se han evaluado los ajustes de dosis en estudios de profilaxis. Farmacocinética en grupos especiales de pacientes: Sexo: En un estudio de dosis múltiples administradas por vía oral, la Cmáx y el AUCt en las mujeres sanas jóvenes fueron un 83% y un 113% más altos, respectivamente, con respecto a los varones sanos jóvenes (18-45 años de edad). En el mismo estudio, no se observaron diferencias significativas de la Cmáx y el AUCt entre los varones ancianos sanos y las mujeres ancianas sanas (≥65 años). En el programa clínico no se realizó ajuste de dosis según el sexo. El perfil de seguridad y las concentraciones plasmáticas observados en pacientes varones y mujeres fueron similares. Por lo tanto, no es necesario ajuste de dosis según el sexo. Ancianos: En un estudio de dosis múltiples administradas por vía oral, la Cmáx y el AUCt de varones ancianos sanos (≥65 años) fueron un 61% y 86% superiores, respectivamente, que la de los varones jóvenes sanos (18-45 años). No se observaron diferencias significativas en la Cmáx y el AUCt entre las mujeres ancianas sanas (≥65 años) y las mujeres jóvenes sanas (18-45 años). En los estudios terapéuticos, no se realizó ajuste de dosis según la edad. Se observó una relación entre las concentraciones plasmáticas y la edad. El perfil de seguridad de voriconazol en pacientes jóvenes y ancianos fue similar y, por lo tanto, no es necesario realizar un ajuste de dosis en los ancianos. Población pediátrica: La dosis oral recomendada en niños se basa en un análisis farmacocinético poblacional de datos procedentes de 47 pacientes pediátricos inmunocomprometidos de 2 a < 12 años de edad que fueron evaluados en un estudio farmacocinético en el que se administraban dosis múltiples de 4 y 6 mg/kg de suspensión oral dos veces al día. Una comparación entre los datos farmacocinéticos de la población pediátrica y adulta indicó que para obtener exposiciones comparables a las obtenidas en adultos tras la administración de la dosis de mantenimiento de 200 mg dos veces al día, en pacientes pediátricos se requiere 200 mg de suspensión oral dos veces al día, independientemente del peso corporal. En pacientes pediátricos hay una tendencia general a una baja biodisponibilidad con los pesos corporales más bajos y a una alta biodisponibilidad con los pesos corporales más altos (acercándose a las cifras observadas en adultos). En base al análisis farmacocinético poblacional, no se requieren ajustes de dosis en función de la edad o del peso en pacientes de 2 a < 12 años de edad en el régimen posológico de 200 mg dos veces al día de suspensión oral. No está indicada la dosis de carga en pacientes pediátricos. La biodisponibilidad oral podría, sin embargo, estar limitada en pacientes pediátricos con malabsorción y con peso corporal muy bajo para su edad. En tales casos, se recomienda la administración de voriconazol intravenoso. Insuficiencia renal: En un estudio con una dosis única oral (200 mg), en sujetos con función renal normal y alteración renal de leve (clearance de creatinina 41-60 ml/min) a grave (clearance de creatinina < 20 ml/min), la alteración renal no influyó significativamente sobre la farmacocinética de voriconazol. La unión a proteínas plasmáticas de voriconazol fue similar en los sujetos con distinto grado de alteración renal. Ver Dosificación y Advertencias. Insuficiencia hepática: Tras una dosis oral única (200 mg), el AUC fue un 233% más alto en sujetos con cirrosis hepática de leve a moderada (Child Pugh A y B) que en los sujetos con función hepática normal. La unión a proteínas plasmáticas de voriconazol no se vio afectada por la insuficiencia hepática. En un estudio con dosis múltiples administradas por vía oral, el AUCt fue similar en sujetos con cirrosis hepática moderada (Child Pugh B) a los que se administró una dosis de mantenimiento de 100 mg dos veces al día y en los sujetos con función hepática normal a los que se administraron 200 mg dos veces al día. No se dispone de datos farmacocinéticos en pacientes con cirrosis hepática grave (Child Pugh C). Ver Dosificación y Advertencias.
Indicaciones.
VFEND, voriconazol, es un fármaco antifúngico triazólico de amplio espectro con las indicaciones siguientes: Tratamiento de aspergilosis invasiva. Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas (ver Farmacología, Microbiología y Experiencia clínica). Tratamiento de infecciones fúngicas graves causadas por Scedosporium spp. y Fusarium spp. Tratamiento de candidiasis esofágica. VFEND se debe administrar principalmente a pacientes con infecciones progresivas con posible amenaza para la vida. Profilaxis de infecciones fúngicas invasivas en los receptores de trasplantes alogénicos de células madre hematopoyéticas (TCMH) de alto riesgo.
Dosificación.
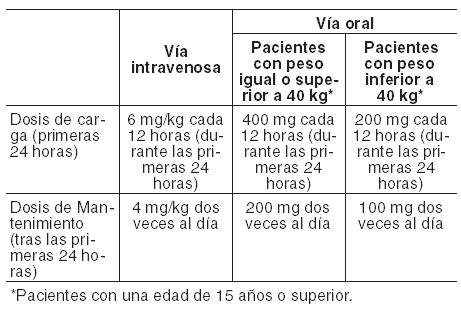
Los comprimidos recubiertos de VFEND deben tomarse una hora antes o una hora después de las comidas. Antes del inicio y durante el tratamiento con voriconazol se deberán monitorear y corregir, siempre que sea necesario, las alteraciones electrolíticas, tales como hipopotasemia, hipomagnesemia e hipocalcemia (Ver Advertencias). Utilización en adultos: Aspergilosis invasiva e infecciones fúngicas graves causadas por Fusarium spp. y Scedosporium spp.: El tratamiento debe iniciarse con la dosis de carga especificada de VFEND intravenoso u oral, para alcanzar concentraciones plasmáticas el Día 1 cercanas al estado estable. Dada su alta biodisponibilidad oral (96%; ver Propiedades Farmacocinéticas), cuando clínicamente esté indicado es adecuado el cambio entre la administración intravenosa y la oral. En la tabla siguiente se proporciona información detallada sobre las recomendaciones posológicas:
Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas: Para el tratamiento de la candidemia en pacientes no neutropénicos y otras infecciones por Candida en tejido profundo, el régimen posológico recomendado es una dosis de ataque de 6 mg/kg administrada cada 12 hs durante las primeras 24 horas, seguida por una dosis de mantenimiento de 3-4 mg/kg administrada cada 12 hs o 200 mg administrados por vía oral cada 12 horas. En los ensayos clínicos, los pacientes con candidemia recibieron 3 mg/kg cada 12 hs como terapia primaria, mientras que los pacientes con otras infecciones por Candida en tejido profundo recibieron 4 mg/kg como terapia de rescate. La dosis adecuada debe conformarse a la gravedad y naturaleza de la infección. Los pacientes deben ser tratados durante un mínimo de 14 días contados a partir de la remisión de los síntomas o del último cultivo positivo, lo que sea posterior. Candidiasis esofágica: Para el tratamiento de candidiasis esofágica se deben usar formas farmacéuticas orales de VFEND. El régimen de dosis recomendado es una administración oral de 200 mg cada 12 horas para pacientes que pesan 40 kg o más. Los pacientes adultos que pesen menos de 40 kg deben recibir una dosis oral de 100 mg cada 12 horas. Los pacientes deben ser tratados por un mínimo de 14 días y por lo menos 7 días después de la desaparición de los síntomas. En caso de uso como profilaxis, consulte la información que figura más adelante. Duración del tratamiento: La duración del tratamiento debe ser la más corta posible en función de la respuesta clínica y micológica del paciente. En caso de tratamientos prolongados con voriconazol que superen los 180 días (6 meses) es necesario realizar una cuidadosa evaluación del balance riesgo-beneficio-. Ver Advertencias, Eventos adversos dermatológicos y Farmacología, Propiedades farmacodinámicas, Duración del tratamiento. Ajuste de la dosis (adultos): Si la respuesta del paciente al tratamiento es inadecuada, la dosis de mantenimiento puede aumentarse a 300 mg dos veces al día por vía oral. En los pacientes con un peso inferior a 40 kg, la dosis oral puede aumentarse a 150 mg dos veces al día. Si el paciente no puede tolerar el tratamiento con una dosis más alta, se reducirá la dosis oral gradualmente de a 50 mg hasta alcanzar 200 mg dos veces al día (o 100 mg cada 12 horas en pacientes con un peso inferior a 40 kg) como dosis de mantenimiento. Utilización en ancianos: No es necesario el ajuste de dosis en los pacientes ancianos (ver Farmacología, Propiedades farmacocinéticas). Utilización en pacientes con insuficiencia renal: La alteración renal no influye en la farmacocinética de voriconazol administrado por vía oral. Por lo tanto, no es necesario ajustar la dosis en pacientes con alteración renal de leve a grave. Voriconazol es hemodializado con un clearance de 121 ml/min. Una sesión de hemodiálisis de 4 horas no elimina una cantidad suficiente de voriconazol como para justificar un ajuste de la dosis (ver Farmacología, Propiedades farmacocinéticas). Utilización en pacientes con insuficiencia hepática: Se recomienda utilizar las pautas normales de dosis de carga pero reducir a la mitad las dosis de mantenimiento en los pacientes con cirrosis hepática de leve a moderada (Child Pugh A y B) en tratamiento con VFEND. El uso de voriconazol no ha sido estudiado en pacientes con cirrosis hepática crónica grave (Child-Pugh C). Existen datos limitados acerca de la seguridad de VFEND en pacientes con pruebas de función hepática anormales (aspartato transaminasa (AST), alanina transaminasa (ALT), fosfatasa alcalina (AP), o bilirrubina total > 5 veces el límite superior de lo normal). Se ha asociado voriconazol con elevaciones de las pruebas de la función hepática y signos clínicos de daño hepático, como ictericia, y sólo debe usarse en pacientes con alteración hepática grave si el beneficio es superior al riesgo potencial. Los pacientes con alteración hepática grave deben ser controlados cuidadosamente por si hubiese toxicidad farmacológica (Ver Reacciones adversas). Utilización en niños (de 2 a < 12 años) y adolescentes jóvenes con un peso corporal bajo (de 12 a 14 años y < 50 kg): VFEND está indicado en niños para los siguientes tratamientos: Aspergilosis invasiva. Infecciones fúngicas graves causadas por Fusarium spp. y Scedosporium spp. Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas. VFEND no está recomendado para su uso en niños menores de 2 años debido a que los datos de seguridad y eficacia son insuficientes (Ver Reacciones adversas y Propiedades Farmacodinámicas). El régimen de dosis de mantenimiento recomendado en pacientes pediátricos de 2 a < 12 años es el siguiente:

Estas recomendaciones posológicas pediátricas están basadas en estudios en los que se administró voriconazol en forma de polvo para suspensión oral. La bioequivalencia entre el polvo para suspensión oral y los comprimidos no se ha investigado en la población pediátrica. La absorción de los comprimidos podría ser diferente en los pacientes pediátricos en comparación con los adultos debido a que el tiempo de tránsito gastrointestinal es más corto en la población pediátrica. Por tanto, en niños de 2 a < 12 años de edad, se recomienda usar la suspensión oral. Adolescentes jóvenes con un peso corporal bajo (de 12 a 14 años y < 50 kg): Voriconazol debe dosificarse como en los niños ya que en dichos adolescentes jóvenes, el metabolismo de voriconazol puede ser más similar al de niños que al de adultos. Todos los adolescentes (12 a 14 años de edad con un peso corporal ≥ 50 kg y de 15 a 17 años de edad con independencia del peso corporal): Voriconazol debe dosificarse como en los adultos. No se ha estudiado el uso en pacientes pediátricos de 2 a < 12 años de edad con insuficiencia hepática o renal. Ver Reacciones adversas y Farmacología, Propiedades Farmacocinéticas. Profilaxis en adultos y niños: La profilaxis se debe iniciar el día del trasplante y puede durar hasta 100 días. Debe ser lo más corta posible en función del riesgo de presentar infección fúngica invasiva (IFI) determinada por neutropenia o inmunosupresión. Únicamente puede prolongarse hasta 180 días tras el trasplante en caso de inmunosupresión persistente o enfermedad de injerto contra huésped (EIcH). Ver Farmacología, Propiedades Farmacodinámicas. Dosis: El régimen posológico recomendado para la profilaxis es el mismo que para el tratamiento en los respectivos grupos de edad. Consulte las tablas de tratamiento anteriores. Duración de la profilaxis: No se han estudiado adecuadamente en los ensayos clínicos la seguridad y la eficacia del uso de voriconazol durante periodos superiores a 180 días. El uso de voriconazol en la profilaxis durante más de 180 días (6 meses) requiere una cuidadosa evaluación del balance riesgo-beneficio, Ver Advertencias y Farmacología, Propiedades Farmacodinámicas. Las siguientes instrucciones son aplicables tanto al tratamiento como a la profilaxis. Ajuste de la dosis: Durante el uso como profilaxis, no se recomienda realizar ajustes de la dosis en caso de ausencia de eficacia o aparición de eventos adversos relacionados con el tratamiento. De presentarse eventos adversos relacionados con el tratamiento, se debe considerar la suspensión del tratamiento con voriconazol y el empleo de fármacos antifúngicos alternativos. Ver Advertencias y Reacciones adversas. Ajustes de la dosis en caso de administración concomitante:Voriconazol se puede administrar de forma concomitante con fenitoína si la dosis de mantenimiento de voriconazol se incrementa de 200 mg a 400 mg por vía oral, dos veces al día (de 100 mg a 200 mg por vía oral dos veces al día en pacientes con un peso inferior a 40 kg). Ver Advertencias e Interacciones. Siempre que sea posible se debe evitar la combinación de voriconazol con rifabutina. Sin embargo, si la combinación es estrictamente necesaria, la dosis de mantenimiento de voriconazol se podría aumentar de 200 a 350 mg por vía oral, dos veces al día (de 100 mg a 200 mg por vía oral dos veces al día en pacientes con un peso inferior a 40 kg). Ver Advertencias e Interacciones. Se puede administrar, de forma conjunta, efavirenz con voriconazol si la dosis de mantenimiento de voriconazol se aumenta a 400 mg cada 12 horas y la dosis de efavirenz se reduce al 50%, es decir, a 300 mg una vez al día. Cuando el tratamiento con voriconazol se interrumpa, se debe restablecer la dosis inicial de efavirenz. Ver Advertencias e Interacciones.
Contraindicaciones.
VFEND está contraindicado en pacientes con hipersensibilidad conocida a voriconazol o a cualquiera de los excipientes. Está contraindicada la administración concomitante de sustratos de CYP3A4, terfenadina, astemizol, cisapride, pimozida o quinidina con voriconazol ya que el incremento de las concentraciones plasmáticas de estos fármacos puede conducir a la prolongación del intervalo QTc y casos poco frecuentes de torsades de pointes. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol con rifampicina, carbamazepina y fenobarbital ya que es probable que estos fármacos reduzcan las concentraciones plasmáticas de voriconazol de forma significativa. Ver Interacciones. La administración concomitante de dosis estándares de voriconazol con dosis de 400 mg de efavirenz o superiores una vez al día está contraindicada, ya que efavirenz disminuye de forma significativa las concentraciones plasmáticas de voriconazol en voluntarios sanos en este rango de dosis. Voriconazol también incrementa significativamente las concentraciones plasmáticas de efavirenz. Ver Interacciones, para dosis inferiores Ver Advertencias. Está contraindicada la administración concomitante de alcaloides ergotamínicos (ergotamina, dihidroergotamina), los cuales son sustratos del CYP3A4, ya que el incremento de las concentraciones plasmáticas de estos fármacos puede provocar ergotismo. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol y sirolimus, ya que es probable que voriconazol incremente las concentraciones plasmáticas de sirolimus de forma significativa. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol con altas dosis de ritonavir (400 mg o más, dos veces al día) porque el ritonavir disminuyó significativamente las concentraciones plasmáticas de voriconazol a estas dosis, en sujetos sanos (Ver Interacciones, para dosis inferiores, Ver Advertencias). Está contraindicado el uso concomitante de voriconazol con la hierba de San Juan (Ver Interacciones).
Reacciones adversas.
El perfil de seguridad de voriconazol en adultos se basa en una base de datos de seguridad integrada por más de 2000 sujetos (de ellos 1603 pacientes en ensayos terapéuticos y 270 en ensayos clínicos de profilaxis). Esto representa una población heterogénea, incluyendo pacientes con neoplasias hematológicas, pacientes infectados por el VIH con candidiasis esofágica e infecciones fúngicas refractarias, pacientes no neutropénicos con candidemia o aspergilosis y voluntarios sanos. Las reacciones adversas más frecuentes fueron discapacidad visual, fiebre, erupción cutánea, vómitos, náuseas, diarrea, dolor de cabeza, edema periférico, pruebas de función hepática anormal, dificultad respiratoria y dolor abdominal. La intensidad de las reacciones adversas fue generalmente de leve a moderada. No se observaron diferencias clínicamente significativas al analizar los datos de seguridad por edad, raza o género. Lista tabulada de reacciones adversas: En la siguiente Tabla, dado que la mayoría de los estudios fueron abiertos, la posible relación causal con el tratamiento y sus categorías por frecuencias, en 1.873 adultos de estudios terap
éuticos combinados (1.603) y de profilaxis (270), se enumeran por sistemas orgánicos. Las categorías de frecuencia son expresadas como: muy frecuente ≥1/10; frecuente ≥1/100 y < 1/10; infrecuente ≥1/1000 y < 1/100, raros ≥1/10000, < 1/1000 y muy raros < 1/10000. Eventos adversos comunicados en sujetos recibiendo voriconazol:
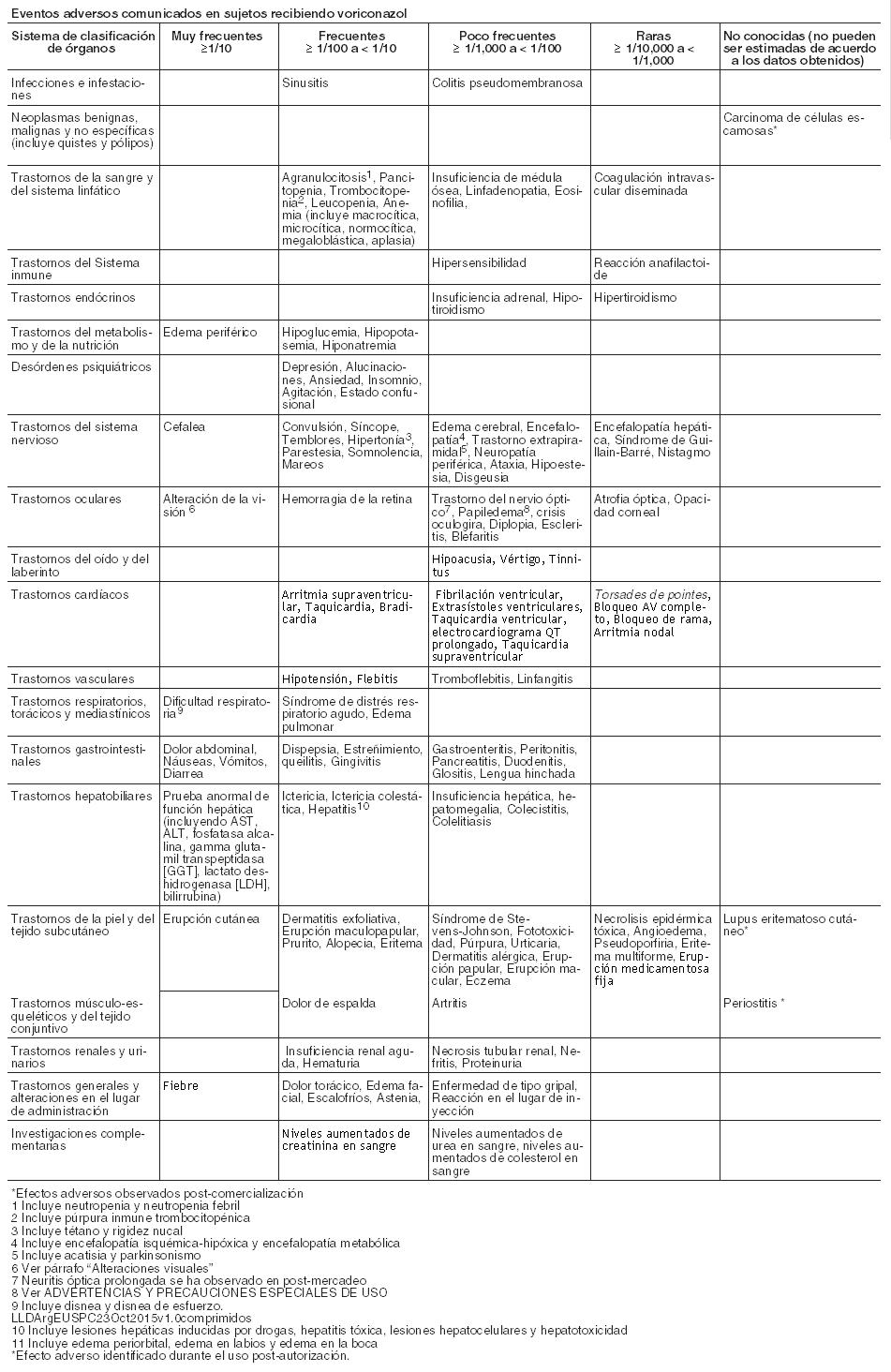
Alteraciones visuales: En los estudios clínicos, las alteraciones visuales con voriconazol (incluyendo visión borrosa, fotofobia, cloropsia, cromatopsia, daltonismo, cianopsia, trastorno ocular, visión halo, ceguera nocturna, oscilopsia, fotopsia, escotoma centelleante, agudeza visual reducida, brillo visual, defecto del campo visual, flotadores vítreos y xantopsia) fueron muy frecuentes. Estos trastornos visuales fueron transitorios y completamente reversibles, resolviéndose la mayoría espontáneamente en 60 minutos y no se han observado efectos visuales clínicamente significativos a largo plazo. Hubo evidencias de atenuación con la administración repetida del voriconazol. Los trastornos visuales fueron generalmente leves, raramente obligaron al abandono del tratamiento y no se asociaron con secuelas a largo plazo. Los trastornos visuales pueden asociarse a mayores concentraciones plasmáticas y/o dosis. Se desconoce el mecanismo de acción, aunque lo más probable es que el lugar de acción sea en la retina. En un estudio con voluntarios sanos en el que se investigaba el efecto de voriconazol sobre la función retiniana, voriconazol originó un descenso de la amplitud de la onda del electrorretinograma (ERG). El ERG mide las corrientes eléctricas en la retina. Las variaciones en el ERG no progresaron durante 29 días de tratamiento, siendo totalmente reversibles tras la retirada de voriconazol. Se han notificado eventos adversos visuales prolongados después de la comercialización. Ver Advertencias. Reacciones dermatológicas: Las reacciones dermatológicas fueron muy frecuentes en pacientes tratados con voriconazol en ensayos clínicos, si bien estos pacientes padecían enfermedades subyacentes graves y recibían múltiples medicaciones concomitantes. La mayoría de las erupciones fueron de intensidad de leve a moderada. Algunos pacientes han presentado reacciones cutáneas graves, incluyendo síndrome de Stevens-Johnson (poco frecuente), necrólisis epidérmica tóxica (raro) y eritema multiforme (raro) durante el tratamiento con VFEND. Si un paciente desarrolla una erupción cutánea, debe ser controlado cuidadosamente y suspenderse el tratamiento con VFEND si las lesiones progresan. Se han registrado reacciones de fotosensibilidad especialmente durante tratamientos prolongados. Ver Advertencias. Se han notificado casos de carcinoma de células escamosas de la piel en los pacientes tratados con voriconazol durante largos períodos de tiempo, el mecanismo no se ha establecido. Ver Advertencias. Pruebas de función hepática: En el programa clínico de voriconazol, la incidencia global de las de transaminasas, aumentó > 3xVN (no siendo un eventos adverso necesariamente), y fue del 18%% (319/1768) en adultos y 25,8% (73/283) en los sujetos pediátricos tratados con voriconazol en un grupo combinado de uso terapéutico y profiláctico). Las alteraciones de las pruebas de función hepática pueden estar asociadas con mayores concentraciones plasmáticas y/o dosis. La mayoría de las alteraciones de las pruebas de función hepática se resolvieron durante el tratamiento sin ajuste de dosis o tras ajustar la dosis, incluyendo la suspensión del tratamiento. Se ha relacionado voriconazol a casos de toxicidad hepática grave en pacientes con otros trastornos subyacentes graves. Estos incluyen casos de ictericia, hepatitis e insuficiencia hepática con resultado de muerte. Ver Advertencias. Profilaxis: En un ensayo abierto, comparativo, multicéntrico, que comparó voriconazol e itraconazol como profilaxis primaria en adultos y adolescentes receptores de TCMH alogénicos sin IFI probada o probable previa, se notificó la suspensión permanente del tratamiento con voriconazol debido a eventos adversos en el 39,3% de los sujetos, frente al 39,6% de los sujetos en el brazo de tratamiento con itraconazol. Los eventos adversos hepáticos emergentes durante el tratamiento, provocaron la suspensión permanente de la medicación del estudio en 50 sujetos (21,4%) tratados con voriconazol y en 18 sujetos (7,1%) tratados con itraconazol. Uso Pediátrico: Se ha investigado la seguridad de voriconazol en 288 pacientes pediátricos de 2 a < 12 años de edad (169) y entre 12 a < 18 años de edad, que recibieron voriconazol como uso profiláctico y en uso terapéutico, durante estudios clínicos. La seguridad de voriconazol se ha investigado en 158 pacientes pediátricos adicionales, entre 2 a < 12 años de edad, en programas de uso compasivo. En general el perfil de seguridad en estos pacientes pediátricos fue similar al de los adultos Sin embargo, se ha reportado como efecto adverso con fecuencia, una tendencia alta al aumento de enzimas hepáticas, en estudios clínicos, en pacientes pediátricos en comparación con adultos (14,2% de las transaminasas aumentadas en pacientes pediátricos, en comparación con 5,3% en adultos). Los datos de la experiencia post-comercialización sugieren que podría haber una mayor incidencia de reacciones cutáneas (especialmente eritema) en la población pediátrica en comparación con los adultos. En 22 pacientes de menos de 2 años de edad que recibieron voriconazol en un programa de uso compasivo, se notificaron los siguientes eventos adversos (para los que no se pudo excluir relación con voriconazol): reacción de fotosensibilidad (1), arritmia (1), pancreatitis (1), bilirrubinemia (1), elevación de enzimas hepáticas (1), rash (1) y papiledema (1). Durante la experiencia post-comercialización se han notificado casos de pancreatitis en pacientes pediátricos. Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación riesgo-beneficio del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas de acuerdo a los requerimientos locales del país.
Advertencias.
Hipersensibilidad: Se recomienda tener precaución al prescribir VFEND a pacientes que hayan presentado reacciones de hipersensibilidad a otros compuestos azólicos. Ver Reacciones adversas. Cardiovascular: Se ha asociado prolongación del intervalo QTc con algunos azoles, incluyendo voriconazol. Raramente, se han reportado casos de torsades de pointes en pacientes que recibían voriconazol y que presentaban factores de riesgo, tales como antecedentes de tratamiento con quimioterapia cardiotóxica, cardiomiopatía, hipopotasemia y medicación concomitante que podría haber contribuido a la aparición de estos casos. Voriconazol deberá ser administrado con precaución a pacientes en situaciones potencialmente proarrítmicas tales como: Prolongación del intervalo QTc adquirida o congénita. Cardiomiopatía, en particular cuando está presente una insuficiencia cardíaca. Bradicardia sinusal. Arritmias asintomáticas. Medicación concomitante de la que se conoce que prolongue el intervalo QTc. Antes del inicio y durante el tratamiento con voriconazol se deberán monitorear y corregir, siempre que sea necesario, las alteraciones electrolíticas, tales como hipopotasemia, hipomagnesemia e hipocalcemia (Ver Dosificación). Se ha realizado un estudio en voluntarios sanos, en el que se examinó el efecto sobre el intervalo QTc del tratamiento con voriconazol a dosis únicas de hasta 4 veces la dosis diaria habitual. Ningún individuo experimentó un intervalo que excediese el umbral con potencial clínicamente relevante de 500 mseg, (ver Farmacología, Propiedades Farmacodinámicas). Toxicidad hepática: En los ensayos clínicos se han comunicado casos de reacciones hepáticas graves durante el tratamiento con VFEND (incluyendo hepatitis clínica, colestasis y falla hepática fulminante, incluyendo fallecimientos). Los casos de reacciones hepáticas tuvieron lugar principalmente en pacientes con patologías graves subyacentes (predominantemente neoplasias hematológicas). Ha habido reacciones hepáticas transitorias, incluyendo hepatitis e ictericia, en pacientes sin ningún otro factor de riesgo identificable. La disfunción hepática generalmente ha sido reversible tras la suspensión del tratamiento. Ver Reacciones adversas. Control de la función hepática: Debe controlarse de manera cuidadosa la toxicidad hepática en pacientes que reciben VFEND. El manejo clínico debe incluir evaluación de laboratorio de la función hepática (específicamente AST y ALT) al inicio del tratamiento con VFEND y al menos una vez por semana durante el primer mes de tratamiento. El tratamiento debe ser tan corto como sea posible, sin embargo, si basado en la evaluación riesgo-beneficio, el tratamiento se continúa (ver Dosificación), puede reducirse la frecuencia del control a mensual si no hay cambios en las pruebas de función hepática. Si las pruebas de función hepática se ven marcadamente elevadas, debe suspenderse el uso de VFEND, a menos que el juicio médico del riesgo-beneficio para el paciente justifique continuar el uso. El control de la función hepática debe llevarse a cabo tanto en niños como en adultos. Eventos adversos visuales: Han habido reportes de eventos adversos visuales prolongados, que incluyen visión borrosa, neuritis óptica y papiledema (Ver Reacciones adversas).
Eventos adversos renales: Se ha observado insuficiencia renal aguda en pacientes gravemente enfermos en tratamiento con VFEND. Los pacientes que están siendo tratados con voriconazol suelen ser tratados al mismo tiempo con otras medicaciones nefrotóxicas y tienen patologías concurrentes que pueden ocasionar la disminución de la función renal. Ver Reacciones adversas. Control de la función renal: Los pacientes deben ser controlados por si se produjese alteración de la función renal. Deberá realizarse una evaluación analítica, concretamente de creatinina sérica. Control de la función pancreática: Se debe controlar cuidadosamente la función pancreática durante el tratamiento con VFEND en los pacientes con factores de riesgo de pancreatitis aguda (por ejemplo, quimioterapia reciente, transplante de células madre hematopoyéticas [HSCT]), especialmente en niños. En estos casos, puede considerarse el monitoreo de amilasa sérica y/o lipasa. Eventos adversos dermatológicos: Durante el tratamiento con VFEND, algunos pacientes han presentado reacciones cutáneas exfoliativas, como síndrome de Stevens-Johnson. Si un paciente presenta una erupción cutánea, debe ser controlado cuidadosamente y si las lesiones progresan debe suspenderse el tratamiento con VFEND. Además, se ha asociado el uso de VFEND con fototoxicidad y pseudoporfiria. Se recomienda que se advierta a todos los pacientes, incluyendo niños, que eviten la exposición a la luz solar durante el tratamiento con voriconazol y que utilicen medidas tales como ropa protectora y pantallas solares con alto factor de protección solar (SPF). Tratamiento a largo plazo: La exposición prolongada (ya sea terapéutica o profiláctica) durante más de 180 días (6 meses) requiere una cuidadosa evaluación del balance riesgo-beneficio y por lo tanto los médicos deben considerar la necesidad de limitar la exposición a VFEND (ver Dosificación y Farmacología, Propiedades farmacodinámicas). En relación al tratamiento de VFEND a largo plazo, se han notificado las siguientes reacciones adversas graves: Se han reportado casos de carcinoma de células escamosas de la piel (CCE) en pacientes, algunos de los cuales habían reportado reacciones de fototoxicidad previas. De ocurrir una reacción fototóxica, debe buscarse un asesoramiento multidisciplinario y el paciente debe derivarse a un dermatólogo. Debe considerarse además la suspensión de VFEND y el empleo de fármacos antifúngicos alternativos. Se debe realizar una evaluación dermatológica en forma sistémica y periódica, cuando se discontinúe usando VFEND a pesar de la aparición de las lesiones relacionadas con la fototoxicidad, para permitir una detección temprana y manejo de las lesiones premalignas. VFEND se debe suspender si se detectan lesiones cutáneas premalignas o carcinoma de células escamosas. En los pacientes trasplantados, se han comunicado casos de periostitis no infecciosa con niveles altos de fluoruro y fosfatasa alcalina. Si el paciente presenta dolor esquelético y hallazgos radiológicos congruentes con la periostitis, debe considerarse la suspensión de VFEND tras asesorarse con un grupo multidisciplinario. Uso pediatría: No se ha estaqblecido la eficacia y se seguridad en niños menores de dos años (ver Reacciones adversas y Propiedades farmacodinámicas). Voriconazol está indicado en pacientes pediátricos de dos años de edad o mayores. Se ha observado una mayor frecuencia de aumento de enzimas hepáticas en pacientes pediátricos (Ver Reacciones adversas). Debería monitorearse la función hepática tanto en niños como en adultos. La biodisponibilidad oral podría estar limitada en pacientes pediátricos de 2 a < 12 años de edad con malabsorción y con peso corporal muy bajo para su edad. En ese caso, se recomienda la administración de voriconazol intravenoso. La frecuencia de las reacciones de fototoxicidad es mayor en la población pediátrica. Se ha notificado una evolución hacia el CCE, por lo que la adopción de medidas rigurosas en relación con la fotoprotección está justificada en esta población de pacientes. En los niños que presenten lesiones de fotoenvejecimiento, como lentigos y efélides, se recomienda evitar el sol y realizar un seguimiento dermatológico, incluso tras la suspensión del tratamiento. Profilaxis: En caso de aparición de eventos adversos relacionados con el tratamiento (hepatotoxicidad, reacciones cutáneas graves, como fototoxicidad y CCE, trastornos visuales graves o prolongados y periostitis), se debe considerar la suspensión del tratamiento con voriconazol y el empleo de fármacos antifúngicos alternativos. Opiáceos de acción corta (sustrato de CYP3A4): Cuando se coadministran con voriconazol, se debe considerar una reducción en la dosis de alfentanil, fentanilo y otros opiáceos de corta duración similares en estructura al alfentanil y a los metabolizados por CYP3A4 (por ejemplo el sulfentanil) (ver Interacciones). Dado que la vida media de eliminación de alfentanilo se cuadruplica cuando éste se administra conjuntamente con voriconazol, y que en un estudio independiente publicado se evidenció un incremento del AUC0-inf de fentanilo, puede ser necesario un monitoreo frecuente de los eventos adversos asociados a opiáceos (incluido un período más largo de monitoreo de la función respiratoria). Opiáceos de acción prolongada (sustratos del CYP3A4): Debería considerarse una reducción de la dosis de oxicodona y de otros opiáceos de acción prolongada que se metabolizan a través del CYP3A4 (por ejemplo hidrocodona) cuando se administran concomitantemente con voriconazol. Puede ser necesario el monitoreo frecuente de los eventos adversos asociados a opiáceos (ver Interacciones). Fluconazol (inhibidor del CYP2C9, CYP2C19 y CYP3A4): La administración concomitante de voriconazol oral y fluconazol puede resultar en un incremento significativo de la Cmáx y del AUC en sujetos sanos. No se ha establecido qué reducción de dosis y/o frecuencia de voriconazol y fluconazol podría eliminar este efecto. Se recomienda monitorear los eventos adversos asociados a voriconazol cuando se administra voriconazol secuencialmente tras la administración de fluconazol (ver Interacciones). Fenitoína (sustrato del CYP2C9 y potente inductor del CYP450): Se recomienda monitorear cuidadosamente las concentraciones de fenitoína cuando se administra de forma concomitante con voriconazol. Debe evitarse el uso concomitante de voriconazol y fenitoína a menos que el beneficio sea superior al riesgo. Ver Interacciones. Rifabutina (inductor potente del CYP450): Se recomienda monitorear cuidadosamente el recuento total de células sanguíneas y los eventos adversos a rifabutina (p.ej.: uveítis) cuando se administra rifabutina de forma concomitante con voriconazol. Debe evitarse el uso concomitante de voriconazol y rifabutina a menos que el beneficio sea superior al riesgo. Ver Interacciones. Metadona (sustrato del CYP3A4): Se recomienda un monitoreo frecuente de los eventos adversos y la toxicidad relacionadas con metadona, incluyendo la prolongación del QTc, cuando se administra concomitantemente con voriconazol, puesto que se incrementan los niveles de metadona tras la coadministración de voriconazol. Puede ser necesaria una reducción de la dosis de metadona (Ver Interacciones). Ritonavir (potente inductor de la CYP450: inhibidor y sustrato de la CYP3A4): Debe evitarse la administración concomitante de voriconazol y dosis bajas de ritonavir (100 mg dos veces al día), a menos que el balance riesgo/beneficio para el paciente justifique el uso de voriconazol (Ver Interacciones, para dosis más altas de ritonavir, ver Contraindicaciones). Efavirenz (inductor de la CYP450: inhibidor y sustrato de la CYP3A4): Cuando el voriconazol es administrado en forma concomitante con efavirenz, la dosis de voriconazol debe ser aumentada a 400 mg dos veces al día y la dosis de efavirenz debe ser disminuida a 300 mg una vez al día (ver Dosficación e Interacciones). Los comprimidos de VFEND contienen lactosa y no deberán administrarse a pacientes con problemas hereditarios raros de intolerancia a galactosa, deficiencia de Lapp lactasa o malabsorción de glucosa-galactosa.
Interacciones.
Salvo que se especifique lo contrario, los estudios de interacción farmacológica han sido realizados en varones sanos utilizando dosis múltiples por vía oral de 200 mg de voriconazol administrado dos veces al día hasta alcanzar el estado estable. Estos resultados son relevantes para otras poblaciones y vías de administración. Este apartado se refiere a los efectos de otros fármacos sobre voriconazol, los efectos de voriconazol sobre otros fármacos y los que ocurran en ambos sentidos. Las interacciones en los dos primeros casos se presentan en el siguiente orden: contraindicaciones, aquellas que precisen ajuste de dosis y un control clínico y/o biológico cuidadoso y finalmente, aquellas que no presenten interacción farmacocinética significativa pero que pueden ser de interés desde el punto de vista clínico en este campo terapéutico. Efectos de otros medicamentos sobre voriconazol: Voriconazol se metaboliza por las isoenzimas del citocromo P450, CYP2C19, CYP2C9 y CYP3A4. Los inhibidores o inductores de estas isoenzimas pueden aumentar o disminuir, respectivamente, las concentraciones plasmáticas de voriconazol. Rifampicina (inductor del CYP450): La administración de rifampicina (600 mg una vez al día) disminuyó la Cmáx (concentración plasmática máxima) y el AUCt (área bajo la curva de concentración plasmática frente al tiempo en un intervalo de dosis) de voriconazol en un 93% y 96%, respectivamente. La administración concomitante de voriconazol y rifampicina está contraindicada. Ver Contraindicaciones. Ritonavir (potente inductor del CYP450; inhibidor y sustrato del CYP3A4): El efecto de la administración de voriconazol oral (200 mg dos veces al día) junto con altas dosis (400 mg) y dosis bajas (100 mg) de ritonavir oral fue investigado en dos estudios separados realizado en voluntarios sanos. Las dosis altas de ritonavir (400 mg dos veces al día) disminuyeron la Cmáx en estado estable y el AUC t del voriconazol oral con un promedio de 66% y 82%, mientras que las dosis bajas de ritonavir (100 mg dos veces al día) disminuyeron la Cmáx y el AUCt del voriconazol en un promedio de 24% y 39%, respectivamente. La administración de voriconazol no tuvo un efecto significativo sobre la media de la Cmáx y del AUCt del ritonavir en el estudio realizado con la dosis alta, aunque se observó una disminución menor de la Cmáx en estado estable y el AUCt del ritonavir con un promedio de 25% y 13%, respectivamente, en el estudio de interacción de dosis baja de ritonavir. En cada uno de los estudios de interacción del ritonavir se identificó un sujeto atípico con niveles elevados de voriconazol. Está contraindicada la coadministración del voriconazol con dosis altas de ritonavir (400 mg y más, dos veces al día). Debe evitarse la administración del voriconazol junto con dosis bajas de ritonavir (100 mg dos veces al día), a menos que una evaluación del riesgo/beneficio del paciente justifique el uso de voriconazol (ver Contraindicaciones y Advertencias). Carbamazepina y fenobarbital (potentes inductores del CYP450): Aunque no se ha estudiado, es probable que carbamazepina o fenobarbital disminuyan significativamente las concentraciones plasmáticas de voriconazol. La administración de voriconazol con carbamazepina y fenobarbital está contraindicada. Ver Contraindicaciones. Cimetidina (inhibidor no específico del CYP450 y aumenta el pH gástrico): La administración de cimetidina (400 mg dos veces al día) aumentó la Cmáx y el AUCt de voriconazol en un 18% y 23%, respectivamente. No se recomienda ajustar la dosis de voriconazol. Ranitidina (aumenta el pH gástrico): La administración de ranitidina (150 mg dos veces al día) no tuvo efectos significativos sobre la Cmáx y el AUCt de voriconazol. Antibióticos macrólidos: La administración de eritromicina (inhibidor del CYP3A4, 1 g dos veces al día) y azitromicina (500 mg una vez al día) no tuvo efectos significativos sobre la Cmáx y el AUCt de voriconazol. Hierba de San Juan (inductor del CYP450; inductor de la gp-P): En un ensayo clínico en voluntarios sanos, se observó que la hierba de San Juan (Hypericum perforatum) producía un corto efecto inhibitorio inicial, seguido de una indución del metabolismo de voriconazol. Después de 15 días de tratamiento con la hierba de San Juan (300 mg tres veces al día), los niveles plasmáticos tras una dosis única de 400 mg de voriconazol disminuyeron en un 40-60%. Por tanto, está contraindicado el uso concomitante de voriconazol con la hierba de San Juan (ver Contraindicaciones). Efectos de voriconazol sobre otros medicamentos: Voriconazol inhibe la actividad de las isoenzimas del citocromo P450, CYP2C19, CYP2C9 y CYP3A4. Por lo tanto, es posible que voriconazol aumente las concentraciones plasmáticas de los fármacos que se metabolizan a través de estas isoenzimas CYP450. El voriconazol debe ser administrado con precaución en los pacientes que estén recibiendo medicación concomitante que prolongue el intervalo QT. Cuando también exista la posibilidad de que el voriconazol aumente los niveles plasmáticos de sustancias metabolizadas por las isoenzimas CPY3A4 (por ejemplo, ciertas antihistaminas, quinidina, cisapride, pimozida) está contraindicada la coadministración (ver debajo y Contraindicaciones). Terfenadina, astemizol, cisapride, pimozida y quinidina (sustratos del CYP3A4): Aunque no se ha estudiado, la administración concomitante de voriconazol con terfenadina, astemizol, cisapride, pimozida o quinidina está contraindicada, puesto que el aumento de las concentraciones plasmáticas de estos fármacos puede producir una prolongación del intervalo QTc y la aparición ocasional de torsades de pointes. Ver Contraindicaciones. Sirolimus (sustrato del CYP3A4): Voriconazol incrementó la Cmáx y el AUCt de sirolimus (dosis única de 2 mg) en un 556% y 1014%, respectivamente. Está contraindicada la administración concomitante de voriconazol y sirolimus. Ver Contraindicaciones. Alcaloides ergotamínicos (sustratos del CYP3A4): Aunque no se ha estudiado, voriconazol puede incrementar las concentraciones plasmáticas de alcaloides ergotamínicos (ergotamina y dihidroergotamina) y provocar ergotismo. Está contraindicada la administración concomitante de voriconazol y alcaloides ergotamínicos. Ver Contraindicaciones. Ciclosporina (sustrato del CYP3A4): En pacientes receptores de transplante renal estabilizados, el tratamiento con voriconazol aumentó la Cmáx y el AUCt de ciclosporina al menos en un 13% y 70%, respectivamente. Cuando se inicia el tratamiento con voriconazol en un paciente que ya recibe tratamiento con ciclosporina, se recomienda disminuir a la mitad la dosis de ciclosporina y monitorear cuidadosamente las concentraciones de ciclosporina. Se han asociado niveles altos de ciclosporina con nefrotoxicidad. Cuando se suspenda el tratamiento con voriconazol, deben controlarse cuidadosamente las concentraciones de ciclosporina y aumentarse la dosis según sea necesario. Metadona (sustrato del CYP3A4): La coadministración de voriconazol (400 mg dos veces al día durante 1 día, seguido de 200 mg dos veces al día durante cuatro días) en sujetos que recibieron una dosis de mantenimiento de metadona (32-100 mg una vez al día) aumentó la Cmáx y el AUC de la R-metadona farmacológicamente activa un 31% y 47% respectivamente, mientras que la Cmáx y el AUC del enantiómero-S incrementaron en aproximadamente el 65% y 103%, respectivamente. Las concentraciones plasmáticas de voriconazol durante la administración concomitante de metadona resultaron comparables a los niveles de voriconazol (datos históricos) en sujetos sanos sin ninguna medicación concomitante. Se recomienda un monitoreo frecuente durante la administración concomitante de las reacciones adversas y la toxicidad relacionadas con el aumento de las concentraciones plasmáticas de metadona, incluyendo la prolongación del QTc. Puede ser necesaria una reducción de la dosis de metadona. Opiáceos de acción corta (sustrato de CYP3A4): La administración en estado estable del voriconazol oral, aumento el AUCt de una dosis única de alfentanil 6 veces más. Cuando se coadministran con voriconazol, se debe considerar la reducción de la dosis del alfentanil y otros opiáceos de acción corta similares en estructura al alfentanil y metabolizados por CYP3A4 (por ejemplo, fentanilo y sulfentanil). Fentanilo (sustrato del CYP3A4): En un estudio independiente publicado, el uso concomitante de voriconazol (400 mg cada 12 horas el Día 1, seguido de 200 mg cada 12 horas el Día 2) con una dosis única de fentanilo por vía intravenosa (5 mg/kg) resultó en un incremento del AUC 0-inf de fentanilo del orden de 1,34 veces (intervalo 1,12-1,60 veces). Cuando se administra voriconazol con fentanilo, se recomienda realizar un monitoreo intenso y frecuente de los pacientes para depresión respiratoria y para otros eventos adversos asociados a fentanilo, y se debe reducir la dosis de fentanilo si es necesario. Opiáceos de acción prolongada (sustrato del CYP3A4): En un estudio independiente publicado, la administración concomitante de dosis múltiples de voriconazol oral (400 mg cada 12 horas el Día 1, seguido de 5 dosis de 200 mg cada 12 horas los Días 2 a 4) con una dosis únical oral de 10 mg de oxicodona el Día 3, resultó en un incremento de la Cmáx media y del AUC 0-inf de oxicodona del orden de 1,7 veces (intervalo 1,4 a 2,2 veces) y de 3,6 veces (intervalo 2,7 a 5,6 veces), respectivamente. La vida media de eliminación de oxicodona también se incrementó en 2,0 veces (intervalo 1,4 a 2,5 veces). Podría ser necesaria una reducción de la dosis de oxicodona y de otros opiáceos de acción prolongada que se metabolizan a través del CYP3A4 (por ejemplo hidrocodona) durante el tratamiento con voriconazol para evitar efectos adversos relacionados con opiáceos. Se recomienda realizar un monitoreo intenso y frecuente de los eventos adversos asociados con oxicodona y otros opiáceos de acción prolongada que se metabolizan por la vía del CYP3A4. Tacrolimus (sustrato del CYP3A4): Voriconazol aumentó la Cmáx y el AUCt (área bajo la curva de concentración frente al tiempo hasta la última determinación cuantificable) de tacrolimus (0,1 mg/kg en dosis única) en un 117% y 221%, respectivamente. Cuando se inicia el tratamiento con voriconazol en un paciente que ya recibe tacrolimus, se recomienda disminuir a la tercera parte la dosis original de tacrolimus y monitorear cuidadosamente las concentraciones de tacrolimus. Se han asociado niveles altos de tacrolimus con nefrotoxicidad. Cuando se suspenda el tratamiento con voriconazol, deben monitorearse cuidadosamente las concentraciones de tacrolimus y aumentarse la dosis según sea necesario. Anticoagulantes orales: Warfarina (sustrato CYP2C9): La administración concomitante de voriconazol (300 mg dos veces al día) con warfarina (30 mg en dosis única) aumentó el tiempo máximo de protrombina en un 93%. Se recomienda controlar cuidadosamente el tiempo de protrombina si se administran concomitantemente warfarina y voriconazol. Otros anticoagulantes orales p.ej.: fenprocumon, acenocumarol (sustratos del CYP2C9, CYP3A4): Aunque no se ha estudiado, voriconazol puede incrementar las concentraciones plasmáticas de los anticoagulantes tipo cumarínico y, por lo tanto, puede causar un incremento en el tiempo de protrombina. En pacientes que reciben anticoagulantes tipo cumarínico simultáneamente con voriconazol deberá controlarse cuidadosamente el tiempo de protrombina a intervalos cortos y ajustar la dosis del anticoagulante de acuerdo a éste. Sulfonilureas (sustratos del CYP2C9): Aunque no se ha estudiado, voriconazol puede aumentar los niveles plasmáticos de las sulfonilureas (p.ej.: tolbutamida, glipizida y gliburida) y producir, por lo tanto, hipoglucemia. Durante la administración concomitante con estos fármacos se recomienda un control estrecho de la glucemia. Estatinas (sustratos del CYP3A4): Aunque no se ha estudiado clínicamente, se ha comprobado que voriconazol inhibe el metabolismo de lovastatina in vitro (microsomas hepáticos humanos). Por lo tanto, es probable que voriconazol aumente los niveles plasmáticos de las estatinas que se metabolizan por el CYP3A4. Se recomienda considerar un ajuste de la dosis de estatinas durante la administración concomitante. Se han asociado concentraciones elevadas de estatinas con rabdomiólisis. Benzodiazepinas (sustratos del CYP3A4): Aunque no se ha estudiado clínicamente, se ha observado que voriconazol inhibe el metabolismo de midazolam in vitro (microsomas hepáticos humanos). Por lo tanto, es probable que voriconazol aumente los niveles plasmáticos de benzodiazepinas que sean metabolizadas por el CYP3A4 (midazolam y triazolam) y prolongue el efecto sedante. Se recomienda considerar un ajuste de la dosis de las benzodiazepinas durante la administración concomitante. Alcaloides de la vinca (sustratos del CYP3A4): Aunque no se ha estudiado, voriconazol puede aumentar los niveles plasmáticos de los alcaloides de la vinca (p. ej.: vincristina y vinblastina) y producir neurotoxicidad. Prednisolona (sustrato CYP3A4): Voriconazol aumentó la Cmáx y el AUCt de prednisolona (dosis única de 60 mg) alrededor de un 11% y 34%, respectivamente. No se recomienda realizar ajuste de dosis. Digoxina (transporte mediado por la P-glicoproteína): Voriconazol no tuvo ningún efecto significativo sobre la Cmáx y el AUCt de digoxina (0,25 mg una vez al día). Acido micofenólico (sustrato de la UDP-glucuronil transferasa): Voriconazol no tuvo efecto sobre la Cmáx y el AUCt del ácido micofenólico (dosis única de 1 g). AINEs (sustratos del CYP2C9): Voriconazol aumentó la Cmáx y el AUC de ibuprofeno (dosis única de 400 mg) en un 20% y en un 100%, respectivamente. Voriconazol aumentó la Cmáx y el AUC de diclofenac (dosis única de 50 mg) en un 114% y un 78%, respectivamente. Se recomienda monitorear los eventos adversos y la toxicidad relacionados con los AINEs. Puede ser necesario ajustar la dosis de los AINEs. Interacciones bidireccionales: Fenitoína (sustrato del CYP2C9 y potente inductor del CYP450): Debe evitarse la administración concomitante con voriconazol y fenitoína a menos que el beneficio sea superior al riesgo. La administración de fenitoína (300 mg una vez al día) disminuyó la Cmáx y el AUCt de voriconazol en un 49% y 69%, respectivamente. La administración de voriconazol (400 mg dos veces al día, ver Dosificación) aumentó la Cmáx y el AUCt de fenitoína (300 mg una vez al día) alrededor de un 67% y un 81%, respectivamente. Se recomienda realizar un control cuidadoso de las concentraciones plasmáticas de fenitoína cuando se administre junto con voriconazol. Se puede administrar fenitoína con voriconazol si la dosis de mantenimiento de voriconazol se aumenta a 5 mg/kg por vía intravenosa dos veces al día o de 200 mg a 400 mg por vía oral dos veces al día (de 100 mg a 200 mg administrados por vía oral dos veces al día en pacientes con un peso inferior a 40 kg). Ver Dosificación. Rifabutina (inductor potente del CYP450): Debe evitarse la administración concomitante de voriconazol y rifabutina a menos que el beneficio sea superior al riesgo. Rifabutina (300 mg una vez al día) disminuyó la Cmáx y el AUCt de voriconazol a la dosis de 200 mg dos veces al día en un 69% y un 78%, respectivamente. Durante la administración concomitante con rifabutina, la Cmáx y el AUCt de voriconazol a la dosis de 350 mg dos veces al día fueron un 96% y un 68% respecto a los niveles alcanzados cuando se administró sólo a la dosis de 200 mg dos veces al día. La Cmáx y el AUCt de voriconazol a la dosis de 400 mg dos veces al día fueron un 104% y un 87% más altos, respectivamente, en comparación con los valores obtenidos con la administración aislada de voriconazol a la dosis de 200 mg dos veces al día. Voriconazol a una dosis de 400 mg dos veces al día incrementó la Cmáx y el AUCt de rifabutina en un 195% y un 331%, respectivamente. Si la administración concomitante de rifabutina y voriconazol está justificada, la dosis de mantenimiento de voriconazol se puede incrementar a 5 mg/kg por vía intravenosa, dos veces al día, o de 200 mg a 350 mg por vía oral, dos veces al día (de 100 mg a 200 mg por vía oral, dos veces al día en pacientes con peso inferior a 40 kg) (ver Dosificación). Se recomienda controlar cuidadosamente el recuento total de células sanguíneas y los eventos adversos a rifabutina (p.ej.: uveítis) cuando se administra concomitantemente rifabutina con voriconazol. Omeprazol (inhibidor del CYP2C19; sustrato del CYP2C19 y CYP3A4): La administración de omeprazol (40 mg una vez al día) aumentó la Cmáx y el AUCt de voriconazol en un 15% y un 41%, respectivamente. No se recomienda el ajuste de dosis de voriconazol. La administración de voriconazol aumentó la Cmáx y el AUCt de omeprazol en un 116% y 280%, respectivamente. Cuando se inicia el tratamiento con voriconazol en pacientes que ya reciben omeprazol, se recomienda reducir a la mitad la dosis de omeprazol. Voriconazol también puede inhibir el metabolismo de otros inhibidores de la bomba de protones que son sustratos del CYP2C19. Anticonceptivos orales: La coadministración de voriconazol con un anticonceptivo oral (1 mg de noretisterona y 0,035 mg de etinilestradiol; una vez al día) en mujeres sanas provocó incrementos de la Cmáx y AUCt del etinilestradiol (36% y 61%, respectivamente) y de la noretisterona (15% y 53%, respectivamente). La Cmáx y AUCt del voriconazol aumentaron en un 14% y 46%, respectivamente. Se espera que los niveles de voriconazol vuelvan a los valores basales durante la semana en la que no se administra el anticonceptivo. Como la relación entre la noretisterona y etinilestradiol permaneció similar durante la interacción con el voriconazol, su actividad de anticoncepción probablemente no estaría afectada. Aunque no se observó aumento de la incidencia de eventos adversos relacionados con la hormona durante el ensayo clínico de interacciones, los niveles más altos de estrógeno y progestágeno podrían producir principalmente náuseas y alteraciones menstruales. No se han estudiado otros anticonceptivos orales que contengan dosis diferentes a las de 1 mg de noretisterona y 0,035 mg de etinilestradiol. Fluconazol (inhibidor del CYP2C9, CYP2C19 y CYP3A4): La administración concomitante de voriconazol por vía oral (400 mg cada 12 horas durante el Día 1, seguido de 200 mg cada 12 horas durante 2,5 días) y fluconazol oral (400 mg el Día 1, seguido de 200 mg cada 24 horas durante 4 días) a 8 sujetos varones sanos resultó en un incremento en la Cmáx y AUCt de voriconazol, en una media del 57% (IC 9°%: 20%, 107%) y del 79% (IC 90%: 40%, 128%), respectivamente. No se ha establecido qué reducción de dosis/frecuencia de voriconazol y fluconazol podría eliminar este efecto. Se recomienda monitorear los eventos adversos asociados a voriconazol cuando se utiliza voriconazol secuencialmente tras la administración de fluconazol. Indinavir (sustrato e inhibidor del CYP3A4): La administración de indinavir (800 mg tres veces al día) no tuvo efectos significativos sobre la Cmáx, Cmín y el AUCt de voriconazol. La administración de voriconazol no tuvo efectos significativos sobre la Cmáx y el AUCt de indinavir (800 mg tres veces al día). Efavirenz (inhibidor de la transcriptasa inversa no nucleósido) (inductor del CYP450; sustrato e inhibidor del CYP3A4): Dosis de efavirenz de 400 mg una vez al día o superiores y dosis estándar de voriconazol no deben ser coadministradas. Una vez alcanzado el estado estable en sujetos sanos (400 mg de efavirenz por vía oral una vez al día administrado concomitantemente con 200 mg de voriconazol dos veces al día), efavirenz disminuyó la Cmáx en estado estable y AUCt de voriconazol en un promedio de 61% y 77%, respectivamente. En el mismo estudio, voriconazol, una vez alcanzado el estado estable en sujetos sanos, aumentó la C max en estado estable y el AUCt de efavirenz en un promedio de 38% y 44%, respectivamente. En un estudio independiente en voluntarios sanos, con dosis de 300 mg de voriconazol dos veces al día en combinación con dosis bajas de efavirenz (300 mg una vez al día) no se alcanzó una exposición suficiente a voriconazol. Tras la administración de 400 mg de voricozanol dos veces al día con 300 mg de efavirenz por vía oral una vez al día, en voluntarios sanos, el AUCt de voricozanol disminuyó en un 7%, y la Cmáx se incrementó en un 23%, en comparación con los valores alcanzados cuando se administra 200 mg de voriconazol dos veces al día sin efavirenz. (El AUCt de efavirenz aumentó en un 17% y la Cmáx fue equivalente en comparación con los valores alcanzados tras la administración de 600 mg de efavirenz una vez al día sin voriconazol). Estas diferencias no se consideraron clínicamente significativas. Cuando el voriconazol es administrado junto con el efavirenz, la dosis de mantenimiento del voriconazol debe aumentarse a 400 mg dos veces al día y la dosis de efavirenz debe disminuirse en un 50%, por ejemplo, a 300 mg una vez al día. Cuando el tratamiento con voriconazol finalice, se restaurará la dosis inicial de efavirenz. Ver Dosificación y Advertencias. Otros
inhibidores de la proteasa del VIH (inhibidores del CYP3A4): Estudios in vitro sugieren que voriconazol puede inhibir el metabolismo de los inhibidores de la proteasa del VIH (p.ej.: saquinavir, amprenavir y nelfinavir). Los estudios in vitro también demuestran que los inhibidores de la proteasa del VIH pueden inhibir el metabolismo de voriconazol. Sin embargo, los resultados de la combinación de voriconazol con otros inhibidores de la proteasa del VIH pueden no ser predecibles en humanos sólo a partir de los estudios in vitro. Se debe controlar cuidadosamente a los pacientes por si apareciese toxicidad y/o pérdida de eficacia durante la administración concomitante de voriconazol e inhibidores de la proteasa del VIH. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN) (sustratos e inhibidores del CYP3A4, o inductores del CYP450): Estudios in vitro demuestran que delavirdina puede inhibir el metabolismo de voriconazol. Aunque no se ha estudiado, nevirapina puede inducir el metabolismo de voriconazol. Un estudio in vivo demostró que voriconazol inhibe el metabolismo de efavirenz. La administración de voriconazol puede también inhibir el metabolismo de los ITINN, además de efavirenz. Debe controlarse cuidadosamente a los pacientes durante la administración concomitante de voriconazol e ITINN por si apareciese toxicidad y/o pérdida de eficacia. Se requiere un ajuste de dosis cuando voriconazol y efavirenz se administren concomitantemente (ver Dosificación y Advertencias). Carcinogénesis, mutagénesis y trastornos de la fertilidad: Estudios toxicológicos con dosis-repetidas de voriconazol indicaron que el hígado es el órgano diana de la toxicidad. La hepatotoxicidad ocurrió a exposiciones plasmáticas similares a las obtenidas con dosis terapéuticas en humanos, al igual que con otros fármacos antifúngicos. En ratas, ratones y perros, voriconazol indujo también cambios adrenales mínimos. Los estudios convencionales de seguridad farmacológica, genotoxicidad o potencial carcinogénico, no han revelado un riesgo especial para los humanos. En estudios de reproducción, voriconazol demostró ser teratogénico en ratas y embriotóxico en conejos con exposiciones sistémicas equivalentes a las obtenidas en humanos con dosis terapéuticas. En el estudio de desarrollo pre y postnatal en ratas expuestas a dosis más bajas que las terapéuticas en humanos, voriconazol prolongó la duración de la gestación y del parto y originó distocia, con la consecuente mortalidad materna y menor supervivencia perinatal de las crías. Los efectos sobre el parto están probablemente mediados por mecanismos específicos en cada especie, implicando reducción de los niveles de estradiol, y son consistentes con los observados con otros fármacos antifúngicos azólicos. Embarazo y lactancia: Embarazo: No se dispone de datos adecuados sobre la utilización de VFEND en mujeres embarazadas. Los estudios en animales han demostrado toxicidad sobre la reproducción. Se desconoce el posible riesgo en humanos. VFEND no debe utilizarse durante el embarazo a menos que los beneficios para la madre superen claramente a los riesgos potenciales para el feto. Mujeres en edad fértil: Las mujeres en edad fértil deben utilizar siempre métodos anticonceptivos eficaces durante el tratamiento. Lactancia: No se ha investigado la excreción de voriconazol en la leche materna. Debe interrumpirse la lactancia al comienzo del tratamiento con VFEND. Efectos sobre la capacidad para conducir y operar maquinarias: VFEND puede ejercer una influencia moderada sobre la capacidad para conducir y utilizar máquinas. La administración de voriconazol puede producir cambios transitorios y reversibles de la visión, incluyendo visión borrosa, percepción visual alterada/aumentada y/o fotofobia. Los pacientes deben evitar realizar tareas potencialmente peligrosas, como conducir o manejar maquinarias mientras presenten estos síntomas.
Conservación.
Conservar a temperatura no mayor a 30°C.
Sobredosificación.
En los ensayos clínicos hubo 3 casos de sobredosis accidental. Todos ocurrieron en niños, que recibieron hasta cinco veces la dosis intravenosa recomendada de voriconazol. Se comunicó un único evento adverso de fotofobia de 10 minutos de duración. No se conoce ningún antídoto frente a voriconazol. Voriconazol es hemodializado con un clearance de 121 ml/min. En caso de sobredosis, la hemodiálisis puede ayudar a eliminar el voriconazol del organismo. Ante la eventualidad de una sobredosificación concurrir al Hospital más cercano o comunicarse a los Centros de Toxicología: Hospital de Pediatría Ricardo Gutiérrez: (011) 4962-6666/2247. Hospital A. Posadas (011) 4658-7777 / 4654-6648.
Presentación.
VFEND 50 mg y 200 mg comprimidos recubiertos: se presenta en envases que contienen 10 comprimidos recubiertos.
Revisión.
Septiembre 2018. LPD: 23/Octubre/2015.
VFEND
PFIZER
Polvo liofilizado p/solución inyectable
Antimicótico sistémico.
Composición.
Cada frasco ampolla contiene: Voriconazol 200 mg. Eter sulfobutílico de b-ciclodextrina sódica (ESBCD) 3,200 mg. Equivalente a 10 mg/ml de voriconazol luego de la reconstitución.
Farmacología.
Propiedades Farmacodinámicas: Grupo farmacoterapéutico: Código ATC: J02A C03. Antimicóticos de uso sistémico, derivados triazólicos. Mecanismo de acción: Voriconazol muestra un amplio espectro de actividad in vitro, con actividad antifúngica frente a especies de Candida (incluyendo C. krusei resistente a fluconazol y cepas resistentes de C. glabrata y C. albicans) y una actividad fungicida frente a todas las especies de Aspergillus estudiadas. Además, voriconazol muestra actividad fungicida in vitro frente a patógenos fúngicos emergentes, incluyendo aquellos como Scedosporium o Fusarium de sensibilidad limitada a los fármacos antifúngicos existentes. Su mecanismo de acción es la inhibición de la 14 a-esterol desmetilasa fúngica dependiente del citocromo P450, una enzima esencial en la biosíntesis del ergosterol. Microbiología: Se ha demostrado eficacia clínica, definida como respuesta completa o parcial frente a Aspergillus spp., incluyendo A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans; Candida spp., incluyendo C. albicans, C. glabrata, C. krusei, C. parapsilosis y C. tropicalis y frente a un número limitado de C. dubliniensis, C. inconspicua, y C. guilliermondii; Scedosporium spp., incluyendo S. apiospermum, S. prolificans y Fusarium spp. Otras infecciones micóticas tratadas (a menudo, con respuesta parcial o completa), incluyeron casos aislados producidos por Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., incluyendo P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis y Trichosporon spp, incluyendo infecciones por T. beigelii. Se ha observado actividad in vitro frente a muestras clínicas de Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp.e Histoplasma capsulatum, siendo inhibidas la mayoría de las cepas por concentraciones de voriconazol entre 0,05 y 2 mg/ml. Se ha demostrado actividad in vitro frente a los patógenos siguientes, si bien se desconoce el significado clínico: Curvularia spp., y Sporothrix spp. Deben obtenerse muestras para cultivo de hongos y otros estudios de laboratorio relevantes (serología, histopatología) antes de comenzar el tratamiento, con el fin de aislar e identificar el microorganismo causal. Puede instaurarse el tratamiento antes de disponer del resultado de los cultivos y de los otros estudios de laboratorio pero, una vez que se disponga de estos resultados, el tratamiento antiinfeccioso debe ajustarse de acuerdo con ellos. Las especies que están implicadas más frecuentemente en infecciones humanas incluyen C. albicans, C. parapsilosis, C. tropicalis, C. glabrata y C. krusei, todas ellas especies que normalmente muestran concentraciones mínimas inhibitorias (CMIs) menores de 1 mg/l para voriconazol. Sin embargo, la actividad in vitro de voriconazol frente a especies de Candida no es uniforme. Específicamente, para C. glabrata, las CIMs de voriconazol para aislados resistentes a fluconazol son proporcionalmente más altas que las correspondientes a las de aislados sensibles a fluconazol. Por tanto, se deben realizar todos los esfuerzos posibles para identificar la especie de Candida. Si se dispone del test de sensibilidad antifúngico, la CIM resultante debe interpretarse utilizando los criterios de los puntos de corte establecidos por el Comité Europeo de Ensayos de Susceptibilidad a Antimicrobianos (EUCAST).
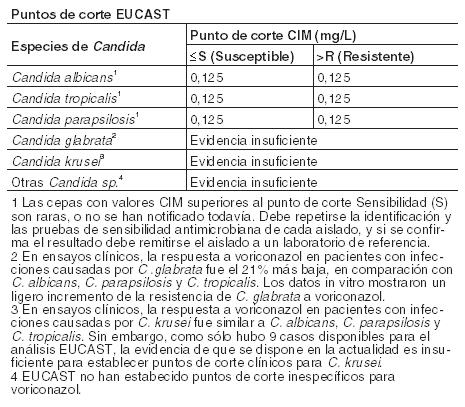
Experiencia clínica: En este apartado se define el resultado satisfactorio como respuesta completa o parcial. Infecciones por Aspergillus - eficacia en pacientes con aspergilosis de mal pronóstico: Voriconazol presenta actividad fungicida in vitro frente a Aspergillus spp. Se demostró la eficacia y beneficio de voriconazol en la supervivencia frente a anfotericina B convencional en el tratamiento primario de la aspergilosis invasiva aguda, en un estudio abierto, randomizado y multicéntrico en 277 pacientes inmunodeprimidos tratados durante 12 semanas. Se observó una respuesta global satisfactoria (resolución completa o parcial de todos los síntomas y signos atribuibles, alteraciones radiográficas/broncoscópicas presentes al inicio del tratamiento) en el 53% de los pacientes tratados con voriconazol frente al 31% en pacientes tratados con el fármaco comparativo. La tasa de supervivencia con voriconazol en el día 84 fue superior en forma estadísticamente significativa a la obtenida con el fármaco comparativo y se demostró un beneficio estadística y clínicamente significativo a favor de voriconazol, tanto con relación al tiempo hasta el fallecimiento como al momento de abandono debido a la toxicidad. Este estudio confirmó hallazgos de un estudio anterior, diseñado prospectivamente en donde se obtuvo un resultado positivo en los pacientes con factores de riesgo de mala evolución, incluyendo enfermedad injerto contra huésped y, en particular, infecciones cerebrales (asociadas normalmente con una mortalidad de casi el 100%). Los estudios incluyeron aspergilosis cerebral, sinusal, pulmonar y diseminada en pacientes con transplante de médula ósea y de órganos sólidos, neoplasias hematológicas, cáncer y SIDA. Candidemia en pacientes no neutropénicos y otras infecciones por Candida en tejidos profundos: Se comparó voriconazol con el régimen de anfotericina B seguido por fluconazol en un estudio abierto y comparativo realizado en pacientes no neutropénicos con candidemia asociada a los signos clínicos de infección (Estudio 608). Los pacientes fueron randomizados en una relación 2:1 a grupos que recibieron voriconazol (n = 283) o el régimen de anfotericina B seguido por fluconazol (n = 139). Los pacientes fueron tratados con la droga de estudio randomizada durante una mediana de 15 días. En la evaluación de eficacia, la mayoría de los casos de candidemia fue causada por C. albicans (46%), seguida por C. tropicalis (19%), C. parapsilosis (17%), C. glabrata (15%) y C. krusei (1%). Un Comité de revisión de datos (DRC) independiente, cegado para el tratamiento de estudio, revisó los datos micológicos y clínicos obtenidos a partir de este estudio y produjo una evaluación de la respuesta para cada paciente. Para una respuesta exitosa se requiere que el paciente presente todas las condiciones que se describen a continuación: remisión por mejoría de todos los signos clínicos y síntomas de infección, cultivos de sangre con resultado negativo para Candida, áreas de tejido profundo infectado con resultado negativo para Candida o remisión de todos los signos de infección sin terapia antifúngica sistémica distinta de la droga del estudio. El análisis primario, que incluyó los éxitos evaluados por el DRC en un momento determinado (12 semanas después de la Finalización del tratamiento [FT]), demostró que voriconazol fue comparable con el régimen de anfotericina B seguido por fluconazol (índices de respuesta del 41% y 41%, respectivamente) para el tratamiento de la candidemia. Los pacientes que por cualquier motivo no fueron evaluados durante 12 semanas, fueron considerados fracasos del tratamiento. En la siguiente tabla se presentan los índices generales de éxito micológico y clínico del Estudio 608, por especie de Candida:
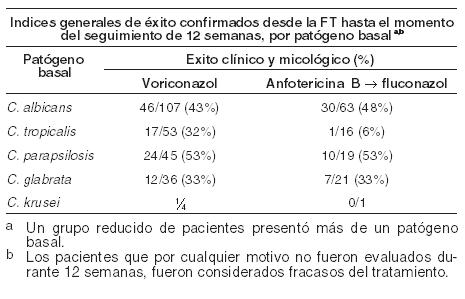
En un análisis secundario, que incluyó la evaluación del DRC en cualquier momento (FT, o 2, 6 ó 12 semanas después de la FT), los índices de respuesta fueron del 65% para voriconazol y del 71% para el régimen de anfotericina B seguido por fluconazol. En los Estudios 608 y 309/604 (estudio no comparativo realizado en pacientes con infecciones fúngicas invasivas que presentaron resistencia o intolerancia a otros agentes antifúngicos), se evaluó voriconazol en 35 pacientes con infecciones por Candida en el tejido profundo. Se observó una respuesta favorable en 4 de 7 pacientes con infecciones intraabdominales, 5 de 6 pacientes con infecciones en la pared de la vejiga y el riñón, 3 de 3 pacientes con infección de heridas o abscesos en tejido profundo, 1 de 2 pacientes con infecciones del espacio pleural/neumonía, 2 de 4 pacientes con lesiones cutáneas, 1 de 1 paciente con infección mixta intraabdominal y pulmonar, 1 de 2 pacientes con flebitis supurativa, 1 de 3 pacientes con infección hepatoesplénica, 1 de 5 pacientes con osteomielitis, 0 de 1 con infección hepática y 0 de 1 con infección del nódulo linfático cervical. Infecciones refractarias graves por Candida: El estudio incluyó a 55 pacientes con infecciones sistemáticas refractarias graves por Candida (incluyendo candidemia, candidiasis diseminada y otras candidiasis invasivas) en las que el tratamiento antifúngico previo, en particular con fluconazol, fue ineficaz. Se observaron resultados favorables en 24 pacientes (15 respuestas completas y 9 respuestas parciales). En especies no albicans resistentes al fluconazol se observó un resultado favorable en 3/3 en el caso de infecciones por C. krusei (respuestas completas) y en 6/8 en el caso de infecciones por C. glabrata (5 respuestas completas, 1 respuesta parcial). Los datos de eficacia clínica estaban apoyados por datos limitados de sensibilidad. Infecciones por Scedosporium y Fusarium: Se ha demostrado que voriconazol es eficaz frente a los siguientes patógenos fúngicos poco frecuentes: Scedosporium spp.: Se observó una respuesta favorable a voriconazol en 16 (6 respuestas completas, 10 respuestas parciales) de 28 pacientes con infección por S. apiospermum y en 2 (ambas respuestas parciales) de 7 pacientes con infección por S. prolificans. Además, se observó una respuesta satisfactoria en 1 de 3 pacientes con infecciones causadas por más de un microorganismo incluyendo Scedosporium spp. Fusarium spp.: El tratamiento con voriconazol tuvo éxito en 7 (3 respuestas completas, 4 respuestas parciales) de 17 pacientes. De estos 7 pacientes, 3 presentaron infecciones oculares, 1 sinusal y 3 diseminadas. Otros 4 pacientes adicionales con fusariosis padecían una infección por varios microorganismos y en 2 de ellos el resultado fue favorable. La mayoría de los pacientes que recibían tratamiento con voriconazol para las infecciones raras mencionadas anteriormente habían sido intolerantes o refractarios a tratamientos antifúngicos previos. Profilaxis primaria de infecciones fúngicas invasivas: eficacia en receptores de TCMH sin (infección fúngica invasiva (IFI) probada o probable previa: Voriconazol se comparó con itraconazol como profilaxis primaria en un estudio abierto, comparativo, multicéntrico, en adultos y adolescentes receptores de TCMH alogénico sin IFI probada o probable previa. El resultado satisfactorio se definió como la capacidad para mantener la profilaxis con el fármaco del estudio durante 100 días tras el TCMH (sin interrupción durante > 14 días) y la supervivencia sin IFI probada o probable durante 180 días tras el TCMH. El grupo por intención de tratar modificado (IDTm) estaba compuesto por 465 receptores de un TCMH alogénico, el 45% de los cuales padecía leucemia mieloide aguda (LMA). El 58% del total de pacientes estaba sometido a un régimen mielosupresor. La profilaxis con el fármaco del estudio se inició inmediatamente después del TCMH: 224 pacientes recibieron voriconazol y 241 recibieron itraconazol. En el análisis por intención de tratar, la mediana de duración de la profilaxis con el fármaco del estudio fue de 96 días en el caso del voriconazol y de 68 días en el caso del itraconazol. En la Tabla siguiente se presentan las tasas de resultado satisfactorio y otras variables secundarias:
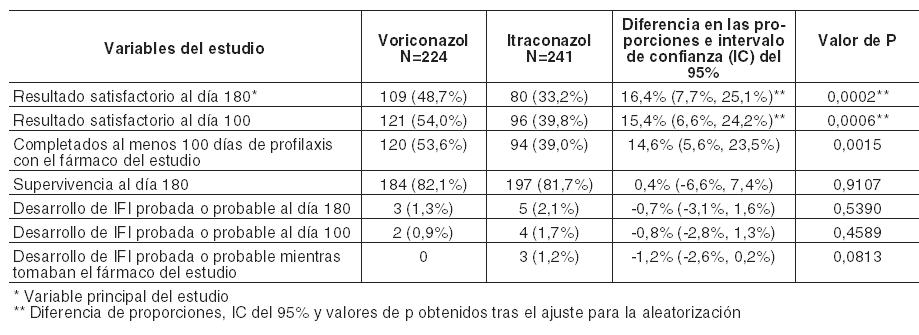
En la Tabla siguiente se presentan el avance de la tasa de IFI al día 180 y la variable principal del estudio (resultado satisfactorio al día 180) para pacientes con LMA y regímenes en condiciones mielosupresoras, respectivamente:
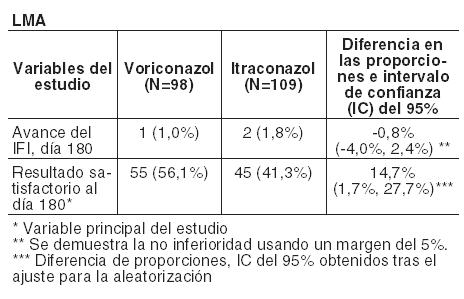
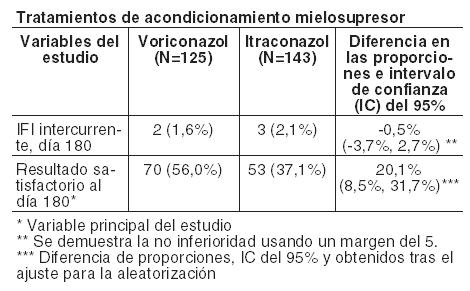
Eficacia de la profilaxis secundaria de IFI en receptores de TCMH con IFI probada o probable previa: Voriconazol se estudió en profilaxis secundaria en un estudio abierto, no comparativo, multicéntrico, en adultos receptores de un TCMH alogénico con IFI probada o probable previa. El punto final primario del estudio fue la tasa de aparición de IFI probada o probable durante el primer año tras el TCMH. El grupo intención de tratar estaba compuesto por 40 pacientes con IFI previa, incluyendo: 31 con aspergilosis, 5 con candidiasis y 4 con otro tipo de IFI. La mediana de duración de la profilaxis con el fármaco del estudio fue de 95,5 días. Durante el primer año posterior al TCMH, el 7,5% de los pacientes (3/40) desarrollaron IFI probada o probable, incluyendo: una candidemia, una scedosporiosis (ambas recidivas de una IFI anterior) y una cigomicosis. La tasa de supervivencia fue del 80,0% (32/40) al día 180 y del 70,0% (28/40) al año. Duración del tratamiento: En los ensayos clínicos, 705 pacientes recibieron tratamiento con voriconazol durante más de 12 semanas y 164 pacientes lo recibieron durante más de 6 meses. Experiencia en pacientes pediátricos: Cincuenta y tres pacientes pediátricos de entre 2 a < 18 años fueron tratados con voriconazol en dos ensayos clínicos prospectivos, de etiqueta abierta, no comparativo, multicéntricos. Un estudio reclutó a 31 pacientes con posible, probada o probable aspergilosis invasiva (AI), de los cuales 14 pacientes habían demostrado o era probable la IA y se incluyeron en los análisis de la eficacia MITT. El segundo estudio incluyó a 22 pacientes con candidiasis invasiva incluyendo candidemia (ICC) y la candidiasis esofágica (CE) que requiere terapia primaria o de rescate, de los cuales 17 se incluyeron en los análisis de la eficacia MITT. Para los pacientes con IA las tasas generales de respuesta global a las 6 semanas fueron 64,3% (9/14), la tasa de respuesta global fue del 40% (05/02) en los pacientes de 2 a < 12 años y el 77,8% (07/09) para los pacientes de 12 a < 18 años de edad. Para los pacientes con ICC la tasa de respuesta global al EOT fue del 85,7% (06/07) y para los pacientes con CE, la tasa de respuesta global al EOT fue del 70% (7/10). La tasa global de respuesta (ICC y EC combinado) fue 88,9% (08/09) de 2 a < 12 años de edad y el 62,5% (05/08) de 12 a < 18 años de edad. Estudios clínicos sobre el intervalo QTc: Se realizó un estudio a dosis únicas, cruzado, aleatorizado y controlado con placebo, con el fin de evaluar el efecto sobre el intervalo QTc en voluntarios sanos, con tres dosis de voriconazol y una de ketoconazol administradas por vía oral. Después de la administración de dosis de 800 mg, 1200 mg y 1600 mg de voriconazol, se obtuvieron unos incrementos máximos medios ajustados a placebo en el QTc desde el inicio, de 5,1; 4,8 y 8,2 mseg, respectivamente, y de 7,0 mseg para una dosis de 800 mg de ketoconazol. De todos los grupos, ningún individuo presentó un incremento en el QTc ≥60 mseg desde el basal. Ningún individuo experimentó un intervalo que excediese el umbral con potencial clínicamente relevante de 500 mseg. Propiedades Farmacocinéticas: Características farmacocinéticas generales: La farmacocinética de voriconazol ha sido descrita en voluntarios sanos, poblaciones especiales y pacientes. Durante la administración oral de 200 mg o 300 mg dos veces al día durante 14 días en pacientes con riesgo de aspergilosis (principalmente pacientes con neoplasias malignas del tejido linfático o hematopoyético), las características farmacocinéticas observadas de absorción rápida y uniforme, acumulación y farmacocinética no lineal concordaron con las observadas en los sujetos sanos. La farmacocinética de voriconazol es no lineal debido a la saturación de su metabolismo. Al aumentar la dosis se obtienen incrementos de la exposición superiores a los proporcionales. Se estima, como media, que el incremento de la dosis por vía oral de 200 mg dos veces al día a 300 mg dos veces al día se traduce en una exposición 2,5 veces mayor (AUCt). Cuando se administran las dosis de carga recomendadas, por vía intravenosa u oral, se alcanzan concentraciones plasmáticas próximas al estado estable en las primeras 24 horas de administración. Cuando no se administra la dosis de carga, se produce acumulación con dosis múltiples, dos veces al día, alcanzándose las concentraciones plasmáticas de voriconazol del estado estable en el Día 6 en la mayoría de los sujetos. Absorción: Voriconazol se absorbe rápida y casi completamente tras la administración oral, alcanzándose concentraciones plasmáticas máximas (Cmáx) en 1-2 horas tras la administración. La biodisponibilidad absoluta de voriconazol tras la administración oral se calcula que es del 96%. Se ha demostrado bioequivalencia entre los comprimidos de 200 mg y la suspensión oral de 40 mg/ml cuando se administra una dosis de carga 400 mg cada 12 horas, seguida de una dosis de mantenimiento de 200 mg cada 12 horas. Cuando se administran dosis múltiples de voriconazol con comidas ricas en grasas la Cmáx y el AUCt se reducen en un 34% y 24%, respectivamente, cuando se administran comprimidos, y en un 58% y 37%, respectivamente, cuando se administran como suspensión oral. La absorción de voriconazol no se ve afectada por los cambios del pH gástrico. Distribución: Se calcula que el volumen de distribución de voriconazol en el estado estable es de 4,6 L/kg, lo que indica una extensa distribución en los tejidos. Se estima que la unión a proteínas plasmáticas es del 58%. Muestras de líquido cefalorraquídeo de 8 pacientes incluidos en un programa de uso compasivo presentaron concentraciones detectables de voriconazol en todos ellos. Metabolismo: Estudios in vitro han demostrado que voriconazol se metaboliza a través de las isoenzimas de citocromo P450 hepático CYP2C19, CYP2C9 y CYP3A4. La variabilidad interindividual de la farmacocinética de voriconazol es alta. Los estudios in vivo indicaron que CYP2C19 participa significativamente en el metabolismo de voriconazol. Esta enzima muestra un polimorfismo genético. Por ejemplo, cabe esperar que el 15-20% de las poblaciones asiáticas sean metabolizadores lentos. En los pacientes de raza caucásica y negra, la prevalencia de metabolizadores lentos es del 3-5%. Los estudios realizados en sujetos sanos de raza caucásica y japoneses han demostrado que los metabolizadores lentos tienen, en promedio, una exposición a voriconazol (AUCt) cuatro veces superior que los metabolizadores rápidos homocigóticos. Los sujetos metabolizadores rápidos heterocigóticos tienen en promedio una exposición dos veces superior a voriconazol que los metabolizadores rápidos homocigóticos. El metabolito principal de voriconazol es el N-óxido, que representa un 72% de los metabolitos radiomarcados circulantes en plasma. Este metabolito presenta una actividad antifúngica mínima que no contribuye a la eficacia global de voriconazol. Excreción: Voriconazol se elimina mediante metabolismo hepático con menos del 2% de la dosis eliminada de forma inalterada en la orina. Tras la administración de una dosis radiomarcada de voriconazol, aproximadamente el 80% de la radioactividad se recupera en orina tras la administración intravenosa de dosis múltiples y el 83% tras la administración oral de dosis múltiples. La mayor parte ( > 94%) de la radioactividad total se excreta en las primeras 96 horas tras la administración tanto oral como intravenosa. La vida media terminal de voriconazol depende de la dosis y es de aproximadamente 6 horas con 200 mg (por vía oral). Debido a la farmacocinética no lineal, la vida media terminal no resulta útil para predecir la acumulación o eliminación de voriconazol. Relación farmacocinética-farmacodinámica: En 10 estudios terapéuticos, la mediana de las concentraciones plasmáticas media y máxima en cada sujeto fue de 2425 ng/ml (rango intercuartil 1193 a 4380 ng/ml) y 3742 ng/ml (rango intercuartil 2027 a 6302 ng/ml), respectivamente. En los estudios terapéuticos no se encontró una asociación positiva entre las concentraciones plasmáticas media, mínima y máxima de voriconazol y la eficacia. Dicha relación no se ha estudiado en los ensayos de profilaxis. Los análisis farmacocinéticos-farmacodinámicos de los datos de los ensayos clínicos identificaron asociaciones positivas entre las concentraciones plasmáticas de voriconazol y las alteraciones tanto de las pruebas de función hepática como de la visión. No se han evaluado los ajustes de dosis en estudios de profilaxis. Farmacocinética en grupos especiales de pacientes: Sexo: En un estudio de dosis múltiples administradas por vía oral, la Cmáx y el AUCt en las mujeres sanas jóvenes fueron un 83% y un 113% más altos, respectivamente, con respecto a los varones sanos jóvenes (18-45 años de edad). En el mismo estudio, no se observaron diferencias significativas del Cmáx y el AUCt entre los varones ancianos sanos y las mujeres ancianas sanas (≥65 años). En el programa clínico no se realizó ajuste de dosis según el sexo. El perfil de seguridad y las concentraciones plasmáticas observados en pacientes varones y mujeres fueron similares. Por lo tanto, no es necesario ajuste de dosis según el sexo. Ancianos: En un estudio de dosis múltiples administradas por vía oral, la Cmáx y el AUCt de varones ancianos sanos (≥65 años) fueron un 61% y 86% superiores, respectivamente, que la de los varones jóvenes sanos (18-45 años). No se observaron diferencias significativas en la Cmáx y el AUCt entre las mujeres ancianas sanas (≥65 años) y las mujeres jóvenes sanas (18-45 años). En los estudios terapéuticos, no se realizó ajuste de dosis según la edad. Se observó una relación entre las concentraciones plasmáticas y la edad. El perfil de seguridad de voriconazol en pacientes jóvenes y ancianos fue similar y, por lo tanto, no es necesario realizar un ajuste de dosis en los ancianos. Población pediátrica: La dosis intravenosa recomendada en pacientes pediátricos se basa en un análisis farmacocinético poblacional de datos combinados procedentes de 82 pacientes pediátricos inmunocomprometidos de 2 a < 12 años de edad que fueron evaluados en tres estudios farmacocinéticos (estudiando dosis únicas intravenosas de 3 y 4 mg/kg dos veces al día, dosis múltiples intravenosas de 3, 4, 6 y 8 mg/kg dos veces al día y dosis múltiples de 4 y 6 mg/kg dos veces al día de suspensión oral). La mayoría de los pacientes recibieron más de un nivel de dosis con una duración máxima de tratamiento de 30 días. Una comparación de los datos farmacocinéticos de la población pediátrica y adulta indicó que para obtener exposiciones comparables a las obtenidas en adultos tras la administración de la dosis intravenosa de mantenimiento de 4 mg/kg dos veces al día, se requirieron dosis intravenosas de mantenimiento de 7 mg/kg dos veces al día en pacientes pediátricos. La mayor dosis intravenosa de mantenimiento en pacientes pediátricos comparado con la de adultos refleja la mayor capacidad de eliminación en pacientes pediátricos debido al mayor tamaño del hígado en relación a la masa corporal. Para conseguir exposiciones similares a las obtenidas en adultos tras la administración de la dosis intravenosa de mantenimiento de 3 mg/kg dos veces al día, se requiere una dosis intravenosa de mantenimiento de 4 mg/kg dos veces al día en pacientes pediátricos. Basándose en el análisis farmacocinético poblacional, en pacientes de 2 a < 12 años de edad no se requiere dosis de carga ni ajustes de dosis en función de la edad. Insuficiencia renal: En pacientes con insuficiencia renal de moderada a grave (niveles de creatinina sérica > 2,5 mg/dl), se produce acumulación del excipiente intravenoso, ESBCD. Ver Dosificacción y Advertencias. Insuficiencia hepática: Tras una dosis oral única (200 mg), el AUC fue un 233% más alta en sujetos con cirrosis hepática de leve a moderada (Child Pugh A y B) que en los sujetos con función hepática normal. La unión a proteínas plasmáticas de voriconazol no se vio afectada por la insuficiencia hepática. En un estudio con dosis múltiples administradas por vía oral, el AUCt fue similar en sujetos con cirrosis hepática moderada (Child Pugh B) a los que se administró una dosis de mantenimiento de 100 mg dos veces al día y en los sujetos con función hepática normal a los que se administraron 200 mg dos veces al día. No se dispone de datos farmacocinéticos en pacientes con cirrosis hepática grave (Child Pugh C). Ver Dosificación y Advertencias.
Indicaciones.
VFEND, voriconazol, es un fármaco antifúngico triazólico de amplio espectro con las indicaciones siguientes: Tratamiento de aspergilosis invasiva. Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas (ver Farmacología, Microbiología y Experiencia clínica). Tratamiento de infecciones fúngicas graves causadas por Scedosporium spp. y Fusarium spp. Tratamiento de candidiasis esofágica. VFEND se debe administrar principalmente a pacientes con infecciones progresivas con posible amenaza para la vida. Profilaxis de infecciones fúngicas invasivas en los receptores de trasplantes alogénicos de células madre hematopoyéticas (TCMH) de alto riesgo.
Dosificación.
VFEND debe ser reconstituido y diluido (ver Instrucciones de Uso y Manipulación) antes de la administración en perfusión intravenosa. No se debe administrar en forma de bolo. Se recomienda administrar VFEND a una velocidad de perfusión máxima de 3 mg/kg/hora durante 1 a 2 horas. Antes del inicio y durante el tratamiento con voriconazol se deberán monitorear y corregir, siempre que sea necesario, las alteraciones electrólíticas, tales como hipopotasemia, hipomagnesemia e hipocalcemia (ver Advertencias, Cardiovascular). El voriconazol no debe ser administrado simultáneamente por la misma vía o cánula junto con otros productos intravenosos. El voriconazol no debe ser administrado simultáneamente junto con algún producto hematológico ni con infusión de soluciones concentradas de electrólitos, aún cuando ambas infusiones estén pasando por vías/cánulas separadas (ver Incompatibilidades). No se requiere la discontinuación de la nutrición parenteral total (NPT) cuando se prescribe con el voriconazol, aunque es necesario que sea administrado a través de una vía/cánula separada (ver Incompatibilidades). Utilización en adultos: Aspergilosis invasiva e infecciones fúngicas graves causadas por Fusarium spp y Scedosporium spp: El tratamiento debe iniciarse con la dosis de carga especificada de VFEND intravenoso u oral para alcanzar concentraciones plasmáticas el Día 1 cercanas al estado estable. Dada su alta biodisponibilidad oral (96%; ver Propiedades Farmacocinéticas), cuando clínicamente esté indicado es adecuado el cambio entre la administración intravenosa y la oral. En la Tabla siguiente se proporciona información detallada sobre las recomendaciones posológicas:
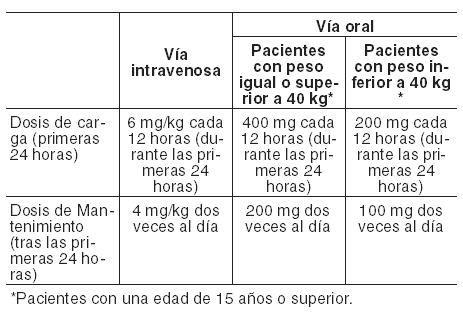
Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas: Para el tratamiento de la candidemia en pacientes no neutropénicos y otras infecciones por Candida en tejido profundo, el régimen posológico recomendado es una dosis de ataque de 6 mg/kg administrada cada 12 hs durante las primeras 24 horas, seguida por una dosis de mantenimiento de 3-4 mg/kg administrada cada 12 hs o 200 mg administrados por vía oral cada 12 horas. En los ensayos clínicos, los pacientes con candidemia recibieron 3 mg/kg cada 12 hs como terapia primaria, mientras que los pacientes con otras infecciones por Candida en tejido profundo recibieron 4 mg/kg como terapia de rescate. La dosis adecuada debe conformarse a la gravedad y naturaleza de la infección. Los pacientes deben ser tratados durante un mínimo de 14 días contados a partir de la remisión de los síntomas o del último cultivo positivo, lo que sea posterior. Candidiasis esofágica: Para el tratamiento de candidiasis esofágica se deben usar formas farmacéuticas orales de VFEND. El régimen de dosis recomendado es una administración oral de 200 mg cada 12 horas para pacientes que pesan 40 kg o más. Los pacientes adultos que pesen menos de 40 kg deben recibir una dosis oral de 100 mg cada 12 horas. Los pacientes deben ser tratados por un mínimo de 14 días y por lo menos 7 días después de la desaparición de los síntomas. En caso de uso como profilaxis, consulte la información que figura más adelante. Duración del tratamiento: La duración del tratamiento debe ser la más corta posible en función de la respuesta clínica y micológica del paciente. En caso de tratamientos prolongados con voriconazol que superen los 180 días (6 meses) es necesario realizar una cuidadosa evaluación del balance beneficio-riesgo. Ver Advertencias, Eventos adversos dermatológicos y Farmacología, Propiedades farmacodinámicas, Duración del tratamiento. Ajuste de la dosis (adultos): Si un paciente no puede tolerar el tratamiento intravenoso con 4 mg/kg cada 12 horas, se reducirá la dosis a 3 mg/kg cada 12 horas. Si la respuesta del paciente al tratamiento es inadecuada, la dosis de mantenimiento puede incrementarse a 300 mg dos veces al día para la administración oral. Para pacientes con un peso inferior a 40 kg, la dosis oral puede incrementarse a 150 mg dos veces al día. Si los pacientes son incapaces de tolerar el tratamiento a estas dosis tan elevadas, reducir la dosis oral en pasos de 50 mg hasta la dosis de mantenimiento de 200 mg dos veces al día (o 100 mg 2 veces al día para pacientes con peso inferior a 40 kg). Utilización en ancianos: No es necesario el ajuste de dosis en los pacientes ancianos (ver Farmacología, Propiedades farmacocinéticas). Utilización en pacientes con insuficiencia renal: En pacientes con alteración renal de moderada a grave (clearance de creatinina < 50 ml/min), se produce acumulación del excipiente de la forma intravenosa, ESBCD. Se deberá administrar voriconazol por vía oral a estos pacientes, a menos que una valoración del riesgo-beneficio en estos pacientes justifique el uso de voriconazol por vía intravenosa. Los niveles de creatinina sérica deberán ser cuidadosamente monitoreados en estos pacientes y, si se incrementaran, se deberá considerar el cambio al tratamiento con voriconazol por vía oral (ver Farmacología, Propiedades farmacocinéticas). Voriconazol es hemodializado con un aclaramiento de 121 ml/min. Una sesión de hemodiálisis de 4 horas no elimina una cantidad suficiente de voriconazol como para justificar un ajuste de la dosis. El vehículo de la forma intravenosa, ESBCD, es hemodializado con un clearance de 55 ml/min. Utilización en pacientes con insuficiencia hepática: Se recomienda utilizar las pautas normales de dosis de carga pero reducir a la mitad las dosis de mantenimiento en los pacientes con cirrosis hepática de leve a moderada (Child Pugh A y B) en tratamiento con VFEND. El uso de voriconazol no ha sido estudiado en pacientes con cirrosis hepática crónica grave (Child-Pugh C). Existen datos limitados acerca de la seguridad de VFEND en pacientes con pruebas de función hepática anormales (aspartato transaminasa (AST), alanina transaminasa (ALT), fosfatasa alcalina (AP), o bilirrubina total > 5 veces el límite superior de lo normal). Se ha asociado voriconazol con elevaciones de las pruebas de la función hepática y signos clínicos de daño hepático, como ictericia, y sólo debe usarse en pacientes con alteración hepática grave si el beneficio es superior al riesgo potencial. Los pacientes con alteración hepática grave deben ser controlados cuidadosamente por si hubiese toxicidad farmacológica (ver Reacciones adversas). Utilización en niños (de 2 a < 12 años) y adolescentes jóvenes con un peso corporal bajo (de 12 a 14 años y < 50 kg): VFEND está indicado en niños para los siguientes tratamientos: Aspergilosis invasiva, Infecciones fúngicas graves causadas por Fusarium spp. y Scedosporium spp., Candidemia en pacientes no neutropénicos y en las siguientes infecciones por Candida: infecciones cutáneas generalizadas e infecciones abdominales, renales, de la pared de la vejiga y de heridas. VFEND no está recomendado para el uso en pacientes pediátricos menores a 2 años debido a que la información de seguridad y eficacia es insuficiente (ver Reacciones adversas y Propiedades Farmacodinámicas). El régimen de dosis de mantenimiento recomendado en pacientes pediátricos de 2 a < 12 años es el siguiente:

Si los pacientes pediátricos no toleran una dosis intravenosa de 7 mg/kg dos veces al día, puede considerarse una reducción de dosis de 7 mg/kg a 4 mg/kg dos veces al día en base al análisis farmacocinético poblacional y a la experiencia clínica previa. Esto origina una exposición equivalente a la de 3 mg/kg dos veces al día en adultos (ver Utilización en adultos). Adolescentes (12 a 14 años de edad con un peso corporal ≥ 50 kg y de 15 a 17 años de edad con independencia del peso corporal): Voriconazol debe dosificarse como en los adultos. No se ha estudiado el uso en pacientes pediátricos de 2 a < 12 años de edad con insuficiencia hepática o renal. Ver Reacciones adversas y Farmacología, Propiedades Farmacocinéticas. Profilaxis en adultos y niños: La profilaxis se debe iniciar el día del trasplante y puede durar hasta 100 días. Debe ser lo más corta posible en función del riesgo de presentar infección fúngica invasiva (IFI) determinada por neutropenia o inmunosupresión. Únicamente puede prolongarse hasta 1
80 días tras el trasplante en caso de inmunosupresión persistente o enfermedad de injerto contra huésped (EIcH). Ver Farmacología, Propiedades Farmacodinámicas. Dosis: El régimen posológico recomendado para la profilaxis es el mismo que para el tratamiento en los respectivos grupos de edad. Consulte las tablas de tratamiento anteriores. Duración de la profilaxis: No se han estudiado adecuadamente en los ensayos clínicos la seguridad y la eficacia del uso de voriconazol durante periodos superiores a 180 días. El uso de voriconazol en la profilaxis durante más de 180 días (6 meses) requiere una cuidadosa evaluación del balance riesgo-beneficio, Ver Advertencias.y Farmacología, Propiedades Farmacodinámicas. Las siguientes instrucciones son aplicables tanto al tratamiento como a la profilaxis. Ajuste de la dosis: Durante el uso como profilaxis, no se recomienda realizar ajustes de la dosis en caso de ausencia de eficacia o aparición de eventos adversos relacionados con el tratamiento. de presentarse eventos adversos relacionados con el tratamiento, se debe considerar la suspensión del tratamiento con voriconazol y el empleo de fármacos antifúngicos alternativos. Ver Advertencias y Reacciones adversas. Ajustes de la dosis en caso de administración concomitante: Voriconazol se puede administrar de forma concomitante con rifabutina o fenitoína si la dosis de mantenimiento de voriconazol se incrementa a 5 mg/kg por vía intravenosa dos veces al día (ver Advertencias e Interacciones). Se puede administrar de forma conjunta, efavirenz con voriconazol si la dosis de mantenimiento de voriconazol se aumenta a 400 mg cada 12 horas y la dosis de efavirenz se reduce al 50%, es decir, a 300 mg una vez al día. Cuando el tratamiento con voriconazol se interrumpa, debe restablecerse la dosis inicial de efavirenz (ver Advertencias e Interacciones). Incompatibilidades: No debe perfundirse VFEND por la misma vía o cánula simultáneamente con otros productos intravenosos. Cuando se completa la infusión de voriconazol, la vía o cánula puede ser utilizada para la administración de otros productos intravenosos. Productos hematológicos e infusión de soluciones concentradas de electrólitos: Las alteraciones de electrólitos tales como hipopotasemia, hipomagnesemia e hipocalcemia deberían ser corregidas antes de comenzar la terapia de voriconazol (ver Advertencias). El voriconazol no debe administrarse simultáneamente con algún producto hematológico ni con infusión de soluciones concentradas de electrólitos, aún si ambas infusiones están pasando por vías/cánulas separadas. Nutrición parenteral total (NPT): No se requiere que la NPT sea discontinuada cuando es prescrita con voriconazol, aunque es necesario que sea infundida a través de una vía o cánula separada. Si es infundida a través de un catéter de múltiple lumen, se requiere que la NPT sea administrada a través de un diferente canal al usado para el voriconazol. El voriconazol no debe ser diluido con infusión de bicarbonato de sodio al 4,2%. No se conoce la compatibilidad con otras concentraciones. No se debe mezclar este producto con ningún otro exceptuando los mencionados (ver Instrucciones de Uso y Manipulación). Instrucciones de Uso y Manipulación: El polvo se reconstituye con 19 ml de agua para preparaciones inyectables para obtener un volumen extraíble de 20 ml de concentrado transparente conteniendo 10 mg/ml de voriconazol. Desechar el frasco ampolla de VFEND si el vacío no permite que el disolvente entre en forma espontánea dentro del frasco ampolla. Se recomienda el uso de una jeringa estándar de 20 ml (no automática) para asegurar la dispensación de la cantidad exacta (19,0 ml) de agua para preparaciones inyectables. Esta especialidad es para un único uso y cualquier solución no utilizada debe ser desechada debiéndose utilizar únicamente soluciones transparentes sin partículas. Para la administración, se añade el volumen requerido del concentrado reconstituido a una solución de perfusión compatible (ver más adelante) para obtener una solución final de VFEND conteniendo 0,5-5 mg/ml.
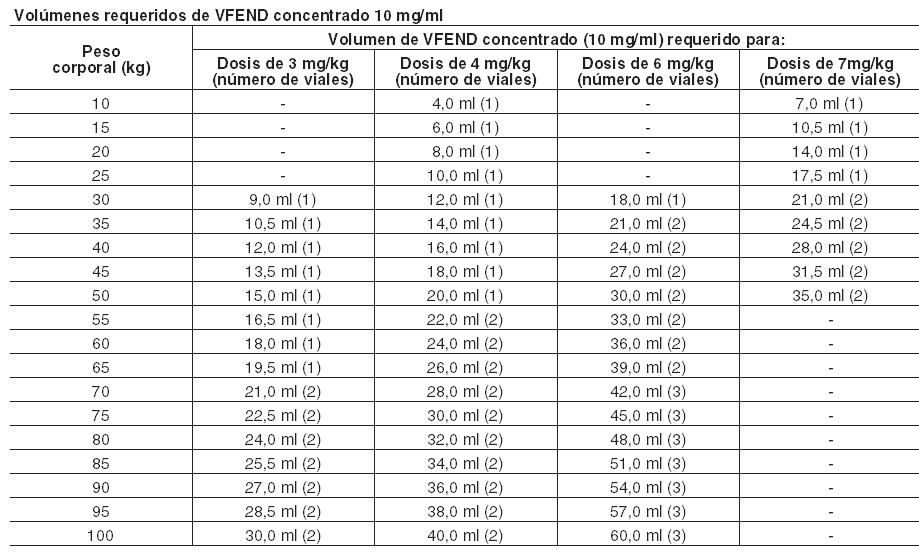
VFEND se presenta como un liofilizado estéril, sin conservantes, de dosis única. Por lo tanto, por razones de seguridad microbiológica, la solución reconstituida debe ser administrada inmediatamente. Si no se utiliza inmediatamente, el tiempo y las condiciones de almacenamiento hasta su uso son responsabilidad de la persona que lo utilice, debiéndose mantener a 2-8°C durante un período máximo de 24 horas a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas. La solución reconstituida puede diluirse con: Solución de cloruro de sodio 9 mg/ml (al 0,9%) para infusión. Solución Ringer lactato para infusión intravenosa. Solución de glucosa al 5% y Ringer lactato para infusión intravenosa. Solución glucosada al 5% con cloruro de sodio al 0,45% para infusión intravenosa. Solución glucosada al 5% para infusión intravenosa. Solución glucosada al 5% con 20 mEq de cloruro de potasio para infusión intravenosa. Solución de cloruro de sodio al 0,45% para infusión intravenosa. Solución de glucosa al 5% con cloruro de sodio al 0,9% para infusión intravenosa. Se desconoce la compatibilidad de VFEND con otros diluyentes distintos a los descritos anteriormente o en Incompatibilidades.
Contraindicaciones.
VFEND está contraindicado en pacientes con hipersensibilidad conocida a voriconazol o a cualquiera de los excipientes. Está contraindicada la administración concomitante de sustratos de CYP3A4, terfenadina, astemizol, cisapride, pimozida o quinidina con voriconazol ya que el incremento de las concentraciones plasmáticas de estos fármacos puede conducir a la prolongación del intervalo QTc y casos poco frecuentes de torsades de pointes. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol con rifampicina, carbamazepina y fenobarbital ya que es probable que estos fármacos reduzcan las concentraciones plasmáticas de voriconazol de forma significativa. Ver Interacciones. La administración concomitante de dosis estándares de voriconazol con dosis de efavirenz de 400 mg o superiores una vez al día está contraindicada, ya que efavirenz disminuye de forma significativa las concentraciones plasmáticas de voriconazol en voluntarios sanos en este rango de dosis. Voriconazol también incrementa significativamente las concentraciones plasmáticas de efavirenz (ver Advertencias e Interacciones). Está contraindicada la administración concomitante de alcaloides ergotamínicos (ergotamina, dihidroergotamina), los cuales son sustratos del CYP3A4, ya que el incremento de las concentraciones plasmáticas de estos fármacos puede provocar ergotismo. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol y sirolimus, ya que es probable que voriconazol incremente las concentraciones plasmáticas de sirolimus de forma significativa. Ver Interacciones. Está contraindicada la administración concomitante de voriconazol con altas dosis de ritonavir (400 mg o más, dos veces al día) porque el ritonavir disminuyó significativamente las concentraciones plasmáticas de voriconazol a estas dosis, en sujetos sanos (ver Interacciones, para dosis inferiores, ver Advertencias). Está contraindicado el uso concomitante de voriconazol con la hierba de San Juan (ver Interacciones).
Reacciones adversas.
El perfil de seguridad de voriconazol en adultos se basa en una base de datos de seguridad integrada por más de 2000 sujetos (de ellos, 1603 pacientes en ensayos terapéuticos y un adicional de 270 en ensayos clínicos de profilaxis). Esto representa una población heterogénea, incluyendo pacientes con neoplasias hematológicas, pacientes infectados por el VIH con candidiasis esofágica e infecciones fúngicas refractarias, pacientes no neutropénicos con candidemia o aspergilosis y voluntarios sanos. Las reacciones adversas más frecuentes fueron discapacidad visual, fiebre, erupción cutánea, vómitos, náuseas, diarrea, dolor de cabeza, edema periférico, pruebas de función hepática anormal, dificultad respiratoria y dolor abdominal. La intensidad de las reacciones adversas fue generalmente de leve a moderada. No se observaron diferencias clínicamente significativas al analizar los datos de seguridad por edad, raza o género. Lista tabulada de reacciones adversas: En la siguiente tabla, dado que la mayoría de los estudios fueron abiertos, la posible relación causal con el tratamiento y sus categorías por frecuencias, en 1.873 adultos de estudios terapéuticos combinados (1.603) y de profilaxis (270), se enumeran por sistemas orgánicos. Las categorías de frecuencia son expresadas como: Muy frecuente ≥1/10; frecuente ≥1/100 y < 1/10; infrecuente ≥1/1000 y < 1/100, raros ≥1/10000, < 1/1000 y muy raros < 1/10000.
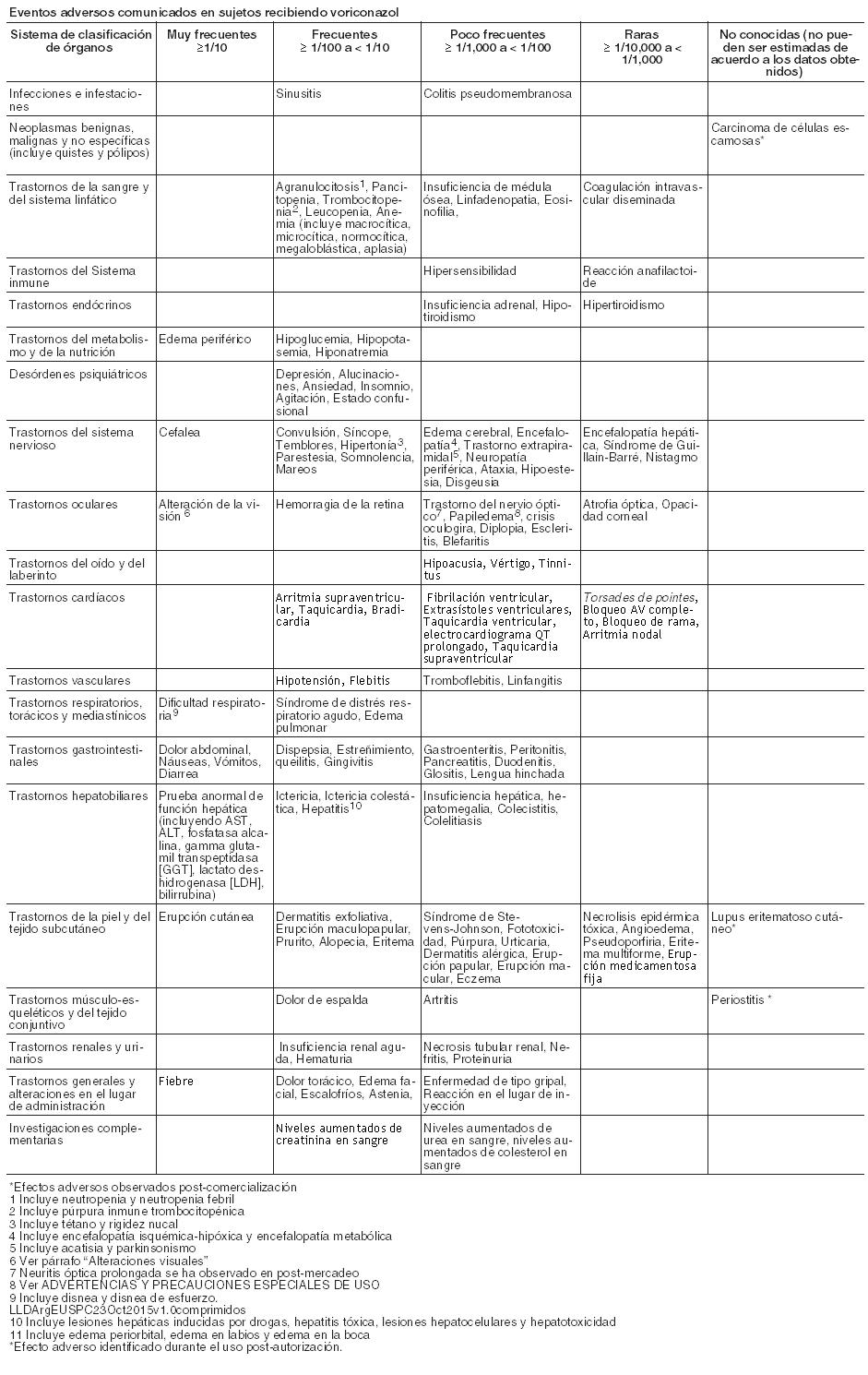
Alteraciones visuales: En los estudios clínicos, las alteraciones visuales (incluyendo visión borrosa, fotofobia, cloropsia, cromatopsia, daltonismo, cianopsia, trastorno ocular, visión halo, ceguera nocturna, oscilopsia, fotopsia, escotoma centelleante, agudeza visual reducida, brillo visual, defecto del campo visual, flotadores vítreos y xantopsia) con voriconazol fueron muy frecuentes. Estos trastornos visuales fueron transitorios y completamente reversibles, resolviéndose la mayoría espontáneamente en 60 minutos y no se han observado efectos visuales clínicamente significativos a largo plazo. Hubo evidencias de atenuación con la administración repetida del voriconazol. Los trastornos visuales fueron generalmente leves, raramente obligaron al abandono del tratamiento y no se asociaron con secuelas a largo plazo. Los trastornos visuales pueden asociarse a mayores concentraciones plasmáticas y/o dosis. Se desconoce el mecanismo de acción, aunque lo más probable es que el lugar de acción sea en la retina. En un estudio con voluntarios sanos en el que se investigaba el efecto de voriconazol sobre la función retiniana, voriconazol originó un descenso de la amplitud de la onda del electrorretinograma (ERG). El ERG mide las corrientes eléctricas en la retina. Las variaciones en el ERG no progresaron durante 29 días de tratamiento, siendo totalmente reversibles tras la retirada de voriconazol. Se han notificado eventos adversos visuales prolongados después de la comercialización. Ver Advertencias. Reacciones dermatológicas: Las reacciones dermatológicas fueron muy frecuentes en pacientes tratados con voriconazol en ensayos clínicos, si bien estos pacientes padecían enfermedades subyacentes graves y recibían múltiples medicaciones concomitantes. La mayoría de las erupciones fueron de intensidad de leve a moderada. Algunos pacientes han presentado reacciones cutáneas graves, incluyendo síndrome de Stevens-Johnson (poco frecuente), necrólisis epidérmica tóxica (raro) y eritema multiforme (raro) durante el tratamiento con VFEND. Si un paciente desarrolla una erupción cutánea, debe ser controlado cuidadosamente y suspenderse el tratamiento con VFEND si las lesiones progresan. Se han registrado reacciones de fotosensibilidad, especialmente durante tratamientos prolongados. Ver Advertencias. Se han notificado casos de carcinoma de células escamosas de la piel en los pacientes tratados con voriconazol durante largos períodos de tiempo, el mecanismo no se ha establecido. Ver Advertencias. Pruebas de función hepática: En el programa clínico de voriconazol, la incidencia global de las transaminasas, aumento > 3xVN (no siendo un eventos adverso necesariamente), y fue del 18,0% (319/1768) en adultos y 25,8% (73/283) en los sujetos pediátricos tratados con voriconazol, en un grupo combinado de uso terapéutico y profiláctico. Las alteraciones de las pruebas de función hepática pueden estar asociadas con mayores concentraciones plasmáticas y/o dosis. La mayoría de las alteraciones de las pruebas de función hepática se resolvieron durante el tratamiento sin ajuste de dosis o tras ajustar la dosis, incluyendo la suspensión del tratamiento. Se ha relacionado voriconazol con casos de toxicidad hepática grave en pacientes con otros trastornos subyacentes graves. Estos incluyen casos de ictericia, hepatitis e insuficiencia hepática con resultado de muerte. Ver Advertencias. Profilaxis: En un ensayo abierto, comparativo, multicéntrico, que comparó voriconazol e itraconazol como profilaxis primaria en adultos y adolescentes receptores de TCMH alogénicos sin IFI probada o probable previa, se notificó la suspensión permanente del tratamiento con voriconazol debido a eventos adversos en el 39,3% de los sujetos, frente al 39,6% de los sujetos en el brazo de tratamiento con itraconazol. Los eventos adversos hepáticos emergentes durante el tratamiento, provocaron la suspensión permanente de la medicación del estudio en 50 sujetos (21,4%) tratados con voriconazol y en 18 sujetos (7,1%) tratados con itraconazol. Reacciones relacionadas con la perfusión: Durante la perfusión de la presentación intravenosa de voriconazol en individuos sanos, han tenido lugar reacciones de tipo anafilactoide, incluyendo enrojecimiento facial, fiebre, sudoración, taquicardia, opresión en el pecho, disnea, desmayo, náuseas, prurito y erupción. Los síntomas aparecían inmediatamente tras el inicio de la perfusión. Ver Advertencias. Uso Pediátrico: Se ha investigado la seguridad de voriconazol en 288 pacientes pediátricos de 2 a < 12 años de edad (169) y entre 12 a < 18 años de edad que recibieron voriconazol como uso profilactico, y en uso terapéutico, durante estudios clínicos. La seguridad de voriconazol se ha investigado en 158 pacientes pediátricos adicionales, entre 2 a < 12 años de edad, en programas de uso compasivo. En general, el perfil de seguridad en pacientes pediátricos fue similar al de los adultos. Sin embargo, se ha reportado como efecto adverso con frecuencia, una tendencia alta al aumento de enzimas hepáticas, en estudios clínicos, en pacientes pediátricos en comparación con adultos (14,2% de las transaminasa aumentadas en pacientes pediátricos, en comparación con 5,3% en adultos). Los datos de la experiencia post-comercialización sugieren que podría haber una mayor incidencia de reacciones cutáneas (especialmente eritema) en la población pediátrica en comparación con los adultos. En 22 pacientes de menos de 2 años de edad que recibieron voriconazol en un programa de uso compasivo, se notificaron los siguientes eventos adversos (para los que no se pudo excluir relación con voriconazol): reacción de fotosensibilidad (1), arritmia (1), pancreatitis (1), bilirrubinemia (1), elevación de enzimas hepáticas (1), rash (1) y papiledema (1). Durante la experiencia post-comercialización se han notificado casos de pancreatitis en pacientes pediátricos. Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas de acuerdo a los requerimientos locales del país.
Advertencias.
Hipersensibilidad: Se recomienda tener precaución al prescribir VFEND a pacientes que hayan presentado reacciones de hipersensibilidad a otros compuestos azólicos. Ver Reacciones adversas. Duración del tratamiento: La duración del tratamiento con la formulación intravenosa no debería exceder los 6 meses (ver Carcinogénesis, mutagénesis y trastornos de la fertilidad). Cardiovascular: Se ha asociado prolongación del intervalo QTc con algunos azoles, incluyendo voriconazol. Raramente, se han reportado casos de torsades de pointes en pacientes que recibían voriconazol y que presentaban factores de riesgo, tales como antecedentes de tratamiento con quimioterapia cardiotóxica, cardiomiopatía, hipopotasemia y medicación concomitante que podría haber contribuido a la aparición de estos casos. Voriconazol deberá ser administrado con precaución a pacientes en situaciones potencialmente proarrítmicas tales como: Prolongación del intervalo QTc adquirida o congénita. Cardiomiopatía, en particular cuando está presente una insuficiencia cardíaca. Bradicardia sinusal. Arritmias asintomáticas. Medicación concomitante de la que se conoce que prolongue el intervalo QTc. Antes del inicio y durante el tratamiento con voriconazol se deberán monitorear y corregir, siempre que sea necesario, las alteraciones electrolíticas, tales como hipopotasemia, hipomagnesemia e hipocalcemia (ver Dosificación). Se ha realizado un estudio en voluntarios sanos, en el que se examinó el efecto sobre el intervalo QTc del tratamiento con voriconazol a dosis únicas de hasta 4 veces la dosis diaria habitual. Ningún individuo experimentó un intervalo que excediese el umbral con potencial clínicamente relevante de 500 mseg (ver Farmacología, Propiedades Farmacodinámicas). Reacciones relacionadas con la perfusión: Se han observado reacciones relacionadas con la perfusión, principalmente enrojecimiento facial y náuseas, durante la administración de la formulación intravenosa de voriconazol. En función de la gravedad de los síntomas, debe considerarse la interrupción del tratamiento. Ver Reacciones adversas. Toxicidad hepática: En los ensayos clínicos se han comunicado casos de reacciones hepáticas graves durante el tratamiento con VFEND (incluyendo hepatitis clínica, colestasis y fallo hepático fulminante, incluyendo fallecimientos). Los casos de reacciones hepáticas tuvieron lugar principalmente en pacientes con patologías graves subyacentes (predominantemente neoplasias hematológicas). Ha habido reacciones hepáticas transitorias, incluyendo hepatitis e ictericia, en pacientes sin ningún otro factor de riesgo identificable. La disfunción hepática generalmente ha sido reversible tras la suspensión del tratamiento. Ver Reacciones adversas. Control de la función hepática: Debe controlarse de manera cuidadosa la toxicidad hepática en pacientes que reciben VFEND. El manejo clínico debe incluir evaluación de laboratorio de la función hepática (específicamente AST y ALT) al inicio del tratamiento con VFEND y al menos una vez por semana durante el primer mes de tratamiento. La duración del tratamiento debe ser tan corto como sea posible, sin embargo, si basado en la evaluación riesgo-beneficio, el tratamiento se continúa (ver Dosificación), puede reducirse la frecuencia del control a mensual si no hay cambios en las pruebas de función hepática. Si las pruebas de función hepática se ven marcadamente elevadas, debe suspenderse el uso de VFEND, a menos que el juicio médico del riesgo-beneficio para el paciente justifique continuar el uso. El control de la función hepática debe llevarse a cabo tanto en niños como en adultos. Eventos adversos visuales: Han habido reportes de eventos adversos visuales prolongados, que incluyen visión borrosa, neuritis óptica y papiledema (ver Reacciones adversas). Eventos adversos renales: Se ha observado insuficiencia renal aguda en pacientes gravemente enfermos en tratamiento con VFEND. Los pacientes que están siendo tratados con voriconazol suelen ser tratados al mismo tiempo con otras medicaciones nefrotóxicas y tienen patologías concurrentes que pueden ocasionar la disminución de la función renal. Ver Reacciones adversas. Control de la función renal: Los pacientes deben ser controlados por si se produjese alteración de la función renal. Deberá realizarse una evaluación analítica, concretamente de creatinina sérica. Control de la función pancreática: Se debe controlar cuidadosamente la función pancreática durante el tratamiento con VFEND en los pacientes con factores de riesgo de pancreatitis aguda (por ejemplo, quimioterapia reciente, transplante de células madre hematopoyéticas [HSCT], especialmente en niños. En estos casos, puede considerarse el monitoreo de amilasa sérica y/o lipasa. Eventos adversos dermatológicos: Durante el tratamiento con VFEND, algunos pacientes han presentado reacciones cutáneas exfoliativas, como síndrome de Stevens-Johnson. Si un paciente presenta una erupción cutánea, debe ser controlado cuidadosamente y si las lesiones progresan debe suspenderse el tratamiento con VFEND. Además, se ha asociado el uso de VFEND con fototoxicidad y pseudoporfiria. Se recomienda que se advierta a todos los pacientes, incluyendo niños, que eviten la exposición a la luz solar durante el tratamiento y que utilicen medidas tales como ropa protectora y pantallas solares con alto factor de protección solar (SPF). Tratamiento a largo plazo: La exposición prolongada (ya sea terapéutica o profiláctica) durante más de 180 días (6 meses) requiere una cuidadosa evaluación del balance riesgo-beneficio y, por lo tanto, los médicos deben considerar la necesidad de limitar la exposición a VFEND (ver Dosificación y Farmacología, Propiedades Farmacodinámicas). Se han comunicado los siguientes eventos adversos graves en relación con el tratamiento con VFEND a largo plazo. Se han comunicado casos de carcinoma de células escamosas (CCE) de la piel en pacientes, algunos de los cuales habían reportado reacciones de fototoxicidad previas. De ocurrir una reacción fototóxica, debe buscarse un asesoramiento multidisciplinario y el paciente debe derivarse a un dermatólogo. Debe considerarse además la suspensión de VFEND y el empleo de fármacos antifúngicos alternativos. Se debe realizar una evaluación dermatológica en forma sistémica y periódica, cuando se discontinúe usando VFEND a pesar de la aparición de las lesiones relacionadas con la fototoxicidad, para permitir una detección temprana y manejo de las lesiones premalignas. VFEND se debe suspender si se detectan lesiones cutáneas premalignas o carcinoma de células escamosas. En los pacientes trasplantados, se han comunicado casos de periostitis no infecciosa con niveles altos de fluoruro y fosfatasa alcalina. Si el paciente presenta dolor esquelético y hallazgos radiológicos congruentes con la periostitis, debe considerarse la suspensión de VFEND tras asesorarse con un grupo multidisciplinario. Uso en pediatría: No se ha establecido la eficacia y la seguridad en niños menores de dos años. Ver Reacciones adversas y Propiedades Farmacodinámicas. Voriconazol está indicado en pacientes pediátricos de dos años de edad o mayores. Se ha observado una mayor frecuencia de aumento de enzimas hepáticas en pacientes pediátricos (ver Reacciones adversas). Debería monitorearse la función hepática tanto en niños como en adultos. La biodisponibilidad oral podría estar limitada en pacientes pediátricos de 2 a < 12 años de edad con malabsorción y con peso corporal muy bajo para su edad. En ese caso, se recomienda la administración de voriconazol intravenoso. La frecuencia de las reacciones de fototoxicidad es mayor en la población pediátrica. Se ha notificado una evolución hacia el CCE, por lo que la adopción de medidas rigurosas en relación con la fotoprotección está justificada en esta población de pacientes. En los niños que presenten lesiones de fotoenvejecimiento, como lentigos y efélides, se recomienda evitar el sol y realizar un seguimiento dermatológico, incluso tras la suspensión del tratamiento. Profilaxis: En caso de aparición de eventos adversos relacionados con el tratamiento (hepatotoxicidad, reacciones cutáneas graves, como fototoxicidad y CCE, trastornos visuales graves o prolongados y periostitis), se debe considerar la suspensión del tratamiento con voriconazol y el empleo de fármacos antifúngicos alternativos. Opiáceos de acción corta (sustrato de CYP3A4): Cuando se coadministran con voriconazol, se debe considerar una reducción en la dosis de alfentanil, fentanilo y otros opiáceos de corta duración similares en estructura al alfentanil y a los metabolizados por CYP3A4 (por ejemplo el sulfentanil) (ver Interacciones). Dado que la vida media de eliminación de alfentanilo se cuadruplica cuando éste se administra conjuntamente con voriconazol, y que en un estudio independiente publicado se evidenció un incremento del AUC 0-inf de fentanilo, puede ser necesario un monitoreo frecuente de los eventos adversos asociados a opiáceos (incluido un período más largo de monitoreo de la función respiratoria). Opiáceos de acción prolongada (sustratos del CYP3A4): Debería considerarse una reducción de la dosis de oxicodona y de otros opiáceos de acción prolongada que se metabolizan a través del CYP3A4 (por ejemplo hidrocodona) cuando se administran concomitantemente con voriconazol. Puede ser necesario el monitoreo frecuente de los eventos adversos asociados a opiáceos (ver Interacciones). Fluconazol (inhibidor del CYP2C9, CYP2C19 y CYP3A4): La administración concomitante de voriconazol oral y fluconazol puede resultar en un incremento significativo de la Cmáx y del AUCt de voriconazol en sujetos sanos. No se ha establecido qué reducción de dosis y/o frecuencia de voriconazol y fluconazol podría eliminar este efecto. Se recomienda monitorear los eventos adversos asociados a voriconazol cuando se administra voriconazol secuencialmente tras la administración de fluconazol (ver Interacciones). Fenitoína (sustrato del CYP2C9 y potente inductor del CYP450): Se recomienda monitorear cuidadosamente las concentraciones de fenitoína cuando se administra de forma concomitante con voriconazol. Debe evitarse el uso concomitante de voriconazol y fenitoína a menos que el beneficio sea superior al riesgo (ver Interacciones). Rifabutina (inductor potente del CYP450): Se recomienda monitorear cuidadosamente el recuento total de células sanguíneas y los eventos adversos a rifabutina (p.ej.: uveítis) cuando se administra rifabutina de forma concomitante con voriconazol. Debe evitarse el uso concomitante de voriconazol y rifabutina a menos que el beneficio sea superior al riesgo (ver Interacciones). Metadona (sustrato del CYP3A4): Se recomienda un monitoreo frecuente de los eventos adversos y la toxicidad relacionadas con metadona, incluyendo la prolongación del QTc, cuando se administra concomitantemente con voriconazol, puesto que se incrementan los niveles de metadona tras la coadministración de voriconazol. Puede ser necesaria una reducción de la dosis de metadona (ver Interacciones). Ritonavir (potente inductor de la CYP450; inhibidor y sustrato de la CYP3A4): Debe evitarse la administración concomitante de voriconazol y dosis bajas de ritonavir (100 mg dos veces al día), a menos que el balance riesgo/beneficio para el paciente justifique el uso de voriconazol (ver Interacciones, para dosis más altas de ritonavir ver Contraindicaciones). Efavirenz (inductor de la CYP450; inhibidor y sustrato de la CYP3A4): Cuando el voriconazol es coadministrado con efavirenz, la dosis de voriconazol debe ser aumentada a 400 mg dos veces al día y la dosis de efavirenz debe ser disminuida a 300 mg una vez al día (ver Dosificación e Interacciones). Contenido de sodio: Cada frasco ampolla de VFEND contiene 217,6 mg de sodio. Esto debe tenerse en cuenta en pacientes que estén recibiendo una dieta controlada en sodio.
Interacciones.
Salvo que se especifique lo contrario, los estudios de interacción farmacológica han sido realizados en varones sanos utilizando dosis múltiples por vía oral de 200 mg de voriconazol administrado dos veces al día hasta alcanzar el estado estable. Estos resultados son relevantes para otras poblaciones y vías de administración. Este apartado se refiere a los efectos de otros fármacos sobre voriconazol, los efectos de voriconazol sobre otros fármacos y los que ocurran en ambos sentidos. Las interacciones en los dos primeros casos se presentan en el siguiente orden: contraindicaciones, aquellas que precisen ajuste de dosis y un control clínico y/o biológico cuidadoso y finalmente, aquellas que no presenten interacción farmacocinética significativa pero que pueden ser de interés desde el punto de vista clínico en este campo terapéutico. Efectos de otros medicamentos sobre voriconazol: Voriconazol se metaboliza por las isoenzimas del citocromo P450, CYP2C19, CYP2C9 y CYP3A4. Los inhibidores o inductores de estas isoenzimas pueden aumentar o disminuir, respectivamente, las concentraciones plasmáticas de voriconazol. Rifampicina (inductor del CYP450): La administración de rifampicina (600 mg una vez al día) disminuyó la Cmáx (concentración plasmática máxima) y el AUCt (área bajo la curva de concentración plasmática frente al tiempo en un intervalo de dosis) de voriconazol en un 93% y 96%, respectivamente. La administración concomitante de voriconazol y rifampicina está contraindicada. Ver Contraindicaciones. Ritonavir (potente inductor del CYP450; inhibidor y sustrato del CYP3A4): El efecto de la administración de voriconazol oral (200 mg dos veces al día) junto con altas dosis (400 mg) y dosis bajas (100 mg) de ritonavir oral fue investigado en dos estudios separados realizado en voluntarios sanos. Las dosis altas de ritonavir (400 mg dos veces al día) disminuyeron la Cmáx en estado estable y el AUCt del voriconazol oral en un promedio de 66% y 82%, mientras que las dosis bajas de ritonavir (100 mg dos veces al día) disminuyeron la Cmáx y el AUCt del voriconazol en un promedio de 24% y 39%, respectivamente. La administración de voriconazol no tuvo un efecto significativo sobre la media de la Cmáx y de la AUCt del ritonavir en el estudio realizado con la dosis alta, aunque se observó una disminución menor de la Cmáx en estado estable y el AUCt del ritonavir con un promedio de 25% y 13%, respectivamente, en el estudio de interacción de dosis baja de ritonavir. En cada uno de los estudios de interacción del ritonavir se identificó un sujeto atípico con niveles elevados de voriconazol. Está contraindicada la administración del voriconazol junto con dosis altas de ritonavir (400 mg y más, dos veces al día). Debe evitarse la administración del voriconazol junto con dosis bajas de ritonavir (100 mg dos veces al día), a menos que una evaluación del riesgo/beneficio del paciente justifique el uso de voriconazol (ver Contraindicaciones y Advertencias). Carbamazepina y fenobarbital (potentes inductores del CYP450): Aunque no se ha estudiado, es probable que carbamazepina o fenobarbital disminuyan significativamente las concentraciones plasmáticas de voriconazol. La administración de voriconazol junto con carbamazepina y fenobarbital está contraindicada. Ver Contraindicaciones. Cimetidina (inhibidor no específico del CYP450 y aumenta el pH gástrico): La administración de cimetidina (400 mg dos veces al día) aumentó la Cmáx y el AUCt de voriconazol en un 18% y 23%, respectivamente. No se recomienda ajustar la dosis de voriconazol. Ranitidina (aumenta el pH gástrico): La administración de ranitidina (150 mg dos veces al día) no tuvo efectos significativos sobre la Cmáx y el AUCt de voriconazol. Antibióticos macrólidos: La administración de eritromicina (inhibidor del CYP3A4, 1 g dos veces al día) y azitromicina (500 mg una vez al día) no tuvo efectos significativos sobre la Cmáx y el AUCt de voriconazol. Hierba de San Juan (inductor del CYP450; inductor de la gp-P): En un ensayo clínico en voluntarios sanos, se observó que la hierba de San Juan (Hypericum perforatum) producía un corto efecto inhibitorio inicial, seguido de una indución del metabolismo de voriconazol. Después de 15 días de tratamiento con la hierba de San Juan (300 mg tres veces al día), los niveles plasmáticos tras una dosis única de 400 mg de voriconazol disminuyeron en un 40-60%. Por tanto, está contraindicado el uso concomitante de voriconazol con la hierba de San Juan (ver Contraindicaciones). Efectos de voriconazol sobre otros medicamentos: Voriconazol inhibe la actividad de las isoenzimas del citocromo P450, CYP2C19, CYP2C9 y CYP3A4. Por lo tanto, es posible que voriconazol aumente las concentraciones plasmáticas de los fármacos que se metabolizan a través de estas isoenzimas CYP450. El voriconazol debe ser administrado con precaución en los pacientes que estén recibiendo medicación concomitante que prolongue el intervalo QT. Cuando también exista la posibilidad de que el voriconazol aumente los niveles plasmáticos de sustancias metabolizadas por las isoenzimas CPY3A4 (por ejemplo, ciertos antihistaminas, quinidina, cisapride, pimozida) está contraindicada la coadministración (ver debajo y Contraindicaciones). Terfenadina, astemizol, cisapride, pimozida y quinidina (sustratos del CYP3A4): Aunque no se ha estudiado, la administración concomitante de voriconazol con terfenadina, astemizol, cisapride, pimozida o quinidina está contraindicada, puesto que el aumento de las concentraciones plasmáticas de estos fármacos puede producir una prolongación del intervalo QTc y la aparición ocasional de torsades de pointes. Ver Contraindicaciones. Sirolimus (sustrato del CYP3A4): Voriconazol incrementó la Cmáx y el AUCt de sirolimus (dosis única de 2 mg) en un 556% y 1014%, respectivamente. Está contraindicada la administración concomitante de voriconazol y sirolimus. Ver Contraindicaciones. Alcaloides ergotamínicos (sustratos del CYP3A4): Aunque no se ha estudiado, voriconazol puede incrementar las concentraciones plasmáticas de alcaloides ergotamínicos (ergotamina y dihidroergotamina) y provocar ergotismo. Está contraindicada la administración concomitante de voriconazol y alcaloides ergotamínicos. Ver Contraindicaciones. Ciclosporina (sustrato del CYP3A4): En pacientes receptores de transplante renal estabilizados, el tratamiento con voriconazol aumentó la Cmáx y el AUCt de ciclosporina al menos en un 13% y 70%, respectivamente. Cuando se inicia el tratamiento con voriconazol en un paciente que ya recibe tratamiento con ciclosporina, se recomienda disminuir a la mitad la dosis de ciclosporina y monitorear cuidadosamente las concentraciones de ciclosporina. Se han asociado niveles altos de ciclosporina con nefrotoxicidad. Cuando se suspenda el tratamiento con voriconazol, deben controlarse cuidadosamente las concentraciones de ciclosporina y aumentarse la dosis según sea necesario. Metadona (sustrato del CYP3A4): La coadministración de voriconazol (400 mg dos veces al día durante 1 día, seguido de 200 mg dos veces al día durante cuatro días) en sujetos que recibieron una dosis de mantenimiento de metadona (32-100 mg una vez al día) aumentó la Cmáx y el AUC de la R-metadona farmacológicamente activa un 31% y 47% respectivamente, mientras que la Cmáx y el AUC del enantiómero-S incrementaron en aproximadamente el 65% y 103%, respectivamente. Las concentraciones plasmáticas de voriconazol durante la administración concomitante de metadona resultaron comparables a los niveles de voriconazol (datos históricos) en sujetos sanos sin ninguna medicación concomitante. Se recomienda un monitoreo frecuente durante la administración concomitante de las reacciones adversas y la toxicidad relacionadas con el aumento de las concentraciones plasmáticas de metadona, incluyendo la prolongación del QT. Puede ser necesaria una reducción de la dosis de metadona. Opiáceos de acción corta (substrato de CYP3A4): La administración en estado estable del voriconazol oral, aumentó el AUCt de una dosis única de alfentanil 6 veces más. Cuando se coadministran con voriconazol, se debe considerar la reducción de la dosis del alfentanil y otros opiáceos de acción corta similares en estructura al alfentanil y metabolizados por CYP3A4 (por ejemplo, fentanilo y sulfentanil). Fentanilo (sustrato del CYP3A4): En un estudio independiente publicado, el uso concomitante de voriconazol (400 mg cada 12 horas el Día 1, seguido de 200 mg cada 12 horas el Día 2) con una dosis única de fentanilo por vía intravenosa (5 mg/kg) resultó en un incremento de la AUC 0-inf de fentanilo del orden de 1,34 veces (intervalo 1,12-1,60 veces). Cuando se administra voriconazol con fentanilo, se recomienda realizar un monitoreo intenso y frecuente de los pacientes para depression respiratoria y para otros eventos adversos asociados a fentanilo, y se debe reducir la dosis de fentanilo si es necesario. Opiáceos de acción prolongada (sustrato del CYP3A4): En un estudio independiente publicado, la administración concomitante de dosis múltiples de voriconazol oral (400 mg cada 12 horas el Día 1, seguido de 5 dosis de 200 mg cada 12 horas los Días 2 a 4) con una dosis únical oral de 10 mg de oxicodona el Día 3, resultó en un incremento de la Cmáx media y del AUC 0-inf de oxicodona del orden de 1,7 veces (intervalo 1,4 a 2,2 veces) y de 3,6 veces (intervalo 2,7 a 5,6 veces), respectivamente. La vida media de eliminación de oxicodona también se incrementó en 2,0 veces (intervalo 1,4 a 2,5 veces). Podría ser necesaria una reducción de la dosis de oxicodona y de otros opiáceos de acción prolongada que se metabolizan a través del CYP3A4 (por ejemplo hidrocodona) durante el tratamiento con voriconazol para evitar efectos adversos relacionados con opiáceos. Se recomienda realizar un monitoreo intenso y frecuente de los eventos adversos asociados con oxicodona y otros opiáceos de acción prolongada que se metabolizan por la vía del CYP3A4. Tacrolimus (sustrato del CYP3A4): Voriconazol aumentó la Cmáx y el AUCt (área bajo la curva de concentración frente al tiempo hasta la última determinación cuantificable) de tacrolimus (0,1 mg/kg en dosis única) en un 117% y 221%, respectivamente. Cuando se inicia el tratamiento con voriconazol en un paciente que ya recibe tacrolimus, se recomienda disminuir a la tercera parte la dosis original de tacrolimus y monitorear cuidadosamente las concentraciones de tacrolimus. Se han asociado niveles altos de tacrolimus con nefrotoxicidad. Cuando se suspenda el tratamiento con voriconazol, deben monitorearse cuidadosamente las concentraciones de tacrolimus y aumentarse la dosis según sea necesario. Anticoagulantes orales: Warfarina (sustrato CYP2C9): La administración concomitante de voriconazol (300 mg dos veces al día) con warfarina (30 mg en dosis única) aumentó el tiempo máximo de protrombina en un 93%. Se recomienda controlar cuidadosamente el tiempo de protrombina si se administran concomitantemente warfarina y voriconazol. Otros anticoagulantes orales p.ej.: fenprocumon, acenocumarol (sustratos del CYP2C9, CYP3A4): Aunque no se ha estudiado, voriconazol puede incrementar las concentraciones plasmáticas de los anticoagulantes tipo cumarínico y, por lo tanto, puede causar un incremento en el tiempo de protrombina. En pacientes que reciben anticoagulantes tipo cumarínico simultáneamente con voriconazol deberá controlarse cuidadosamente el tiempo de protrombina a intervalos cortos y ajustar la dosis del anticoagulante de acuerdo a éste. Sulfonilureas (sustratos del CYP2C9): Aunque no se ha estudiado, voriconazol puede aumentar los niveles plasmáticos de las sulfonilureas (p.ej.: tolbutamida, glipizida y gliburida) y producir, por lo tanto, hipoglucemia. Durante la administración concomitante con estos fármacos se recomienda un control estrecho de la glucemia. Estatinas (sustratos del CYP3A4): Aunque no se ha estudiado clínicamente, se ha comprobado que voriconazol inhibe el metabolismo de lovastatina in vitro (microsomas hepáticos humanos). Por lo tanto, es probable que voriconazol aumente los niveles plasmático
s de las estatinas que se metabolizan por el CYP3A4. Se recomienda considerar un ajuste de la dosis de estatinas durante la administración concomitante. Se han asociado concentraciones elevadas de estatinas con rabdomiólisis. Benzodiazepinas (sustratos del CYP3A4): Aunque no se ha estudiado clínicamente, se ha observado que voriconazol inhibe el metabolismo de midazolam in vitro (microsomas hepáticos humanos). Por lo tanto, es probable que voriconazol aumente los niveles plasmáticos de benzodiazepinas que sean metabolizadas por el CYP3A4 (midazolam y triazolam) y prolongue el efecto sedante. Se recomienda considerar un ajuste de la dosis de las benzodiazepinas durante la administración concomitante. Alcaloides de la vinca (sustratos del CYP3A4): Aunque no se ha estudiado, voriconazol puede aumentar los niveles plasmáticos de los alcaloides de la vinca (p. ej.: vincristina y vinblastina) y producir neurotoxicidad. Prednisolona (sustrato CYP3A4): Voriconazol aumentó la Cmáx y el AUCt de prednisolona (dosis única de 60 mg) alrededor de un 11% y 34%, respectivamente. No se recomienda realizar ajuste de dosis. Digoxina (transporte mediado por la P-glicoproteína): Voriconazol no tuvo ningún efecto significativo sobre la Cmáx y el AUCt de digoxina (0,25 mg una vez al día). Acido micofenólico (sustrato de la UDP-glucuronil transferasa): Voriconazol no tuvo efecto sobre la Cmáx y el AUCt del ácido micofenólico (dosis única de 1 g). AINEs (sustratos del CYP2C9): Voriconazol aumentó la Cmáx y el AUC de ibuprofeno (dosis única de 400 mg) en un 20% y en un 100%, respectivamente. Voriconazol aumentó la Cmáx y el AUC de diclofenac (dosis única de 50 mg) en un 114% y un 78%, respectivamente. Se recomienda monitorear los eventos adversos y la toxicidad relacionados con los AINEs. Puede ser necesario ajustar la dosis de los AINEs. Interacciones bidireccionales: Fenitoína (sustrato del CYP2C9 y potente inductor del CYP450): Debe evitarse la administración concomitante con voriconazol y fenitoína a menos que el beneficio sea superior al riesgo. La administración de fenitoína (300 mg una vez al día) disminuyó la Cmáx y el AUCt de voriconazol en un 49% y 69%, respectivamente. La administración de voriconazol (400 mg dos veces al día, ver Dosificación) aumentó la Cmáx y el AUCt de fenitoína (300 mg una vez al día) alrededor de un 67% y un 81%, respectivamente. Se recomienda realizar un control cuidadoso de las concentraciones plasmáticas de fenitoína cuando se administre junto con voriconazol. Se puede administrar fenitoína con voriconazol si la dosis de mantenimiento de voriconazol se aumenta a 5 mg/kg por vía intravenosa dos veces al día o de 200 mg a 400 mg por vía oral dos veces al día (de 100 mg a 200 mg administrados por vía oral dos veces al día en pacientes con un peso inferior a 40 kg). Ver Dosificación. Rifabutina (inductor potente del CYP450): Debe evitarse la administración concomitante de voriconazol y rifabutina a menos que el beneficio sea superior al riesgo. Rifabutina (300 mg una vez al día) disminuyó la Cmáx y el AUCt de voriconazol a la dosis de 200 mg dos veces al día en un 69% y un 78%, respectivamente. Durante la administración concomitante con rifabutina, la Cmáx y el AUCt de voriconazol a la dosis de 350 mg dos veces al día fueron un 96% y un 68% respecto a los niveles alcanzados cuando se administró sólo a la dosis de 200 mg dos veces al día. La Cmáx y el AUCt de voriconazol a la dosis de 400 mg dos veces al día fueron un 104% y un 87% más altos, respectivamente, en comparación con los valores obtenidos con la administración aislada de voriconazol a la dosis de 200 mg dos veces al día. Voriconazol a una dosis de 400 mg dos veces al día incrementó la Cmáx y el AUCt de rifabutina en un 195% y un 331%, respectivamente. Si la administración concomitante de rifabutina y voriconazol está justificada, la dosis de mantenimiento de voriconazol se puede incrementar a 5 mg/kg por vía intravenosa, dos veces al día, o de 200 mg a 350 mg por vía oral, dos veces al día (de 100 mg a 200 mg por vía oral, dos veces al día en pacientes con peso inferior a 40 kg) (ver Dosificación). Se recomienda controlar cuidadosamente el recuento total de células sanguíneas y los eventos adversos a rifabutina (p.ej.: uveitis) cuando se administra concomitantemente rifabutina con voriconazol. Omeprazol (inhibidor del CYP2C19; sustrato del CYP2C19 y CYP3A4): La administración de omeprazol (40 mg una vez al día) aumentó la Cmáx y el AUCt de voriconazol en un 15% y un 41%, respectivamente. No se recomienda el ajuste de dosis de voriconazol. La administración de voriconazol aumentó la Cmáx y el AUCt de omeprazol en un 116% y 280%, respectivamente. Cuando se inicia el tratamiento con voriconazol en pacientes que ya reciben omeprazol, se recomienda reducir a la mitad la dosis de omeprazol. Voriconazol también puede inhibir el metabolismo de otros inhibidores de la bomba de protones que son sustratos del CYP2C19. Anticonceptivos orales: La coadministración de voriconazol con un anticonceptivo oral (1 mg de noretisterona y 0,035 mg de etinilestradiol; una vez al día) en mujeres sanas provocó incrementos de la Cmáx y AUCt del etinilestradiol (36% y 61%, respectivamente) y de la noretisterona (15% y 53%, respectivamente). La Cmáx y AUCt del voriconazol aumentaron en un 14% y 46%, respectivamente. Se espera que los niveles de voriconazol vuelvan a los valores basales durante la semana en la que no se administra el anticonceptivo. Como la relación entre la noretisterona y etinilestradiol permaneció similar durante la interacción con el voriconazol, su actividad de anticoncepción probablemente no estaría afectada. Aunque no se observó aumento de la incidencia de eventos adversos relacionados con la hormona durante el ensayo clínico de interacciones, los niveles más altos de estrógeno y progestágeno podrían producir principalmente náuseas y alteraciones menstruales. No se han estudiado otros anticonceptivos orales que contengan dosis diferentes a las de 1 mg de noretisterona y 0,035 mg de etinilestradiol. Fluconazol (inhibidor del CYP2C9, CYP2C19 y CYP3A4): La administración concomitante de voriconazol por vía oral (400 mg cada 12 horas durante el Día 1, seguido de 200 mg cada 12 horas durante 2,5 días) y fluconazol oral (400 mg el Día 1, seguido de 200 mg cada 24 horas durante 4 días) a 8 sujetos varones sanos resultó en un incremento en la Cmáx y AUCt de voriconazol, en una media del 57% (IC 9°%: 20%, 107%) y del 79% (IC 90%: 40%, 128%), respectivamente. No se ha establecido qué reducción de dosis/frecuencia de voriconazol y fluconazol podría eliminar este efecto. Se recomienda monitorear los eventos adversos asociados a voriconazol cuando se utiliza voriconazol secuencialmente tras la administración de fluconazol. Indinavir (sustrato e inhibidor del CYP3A4): La administración de indinavir (800 mg tres veces al día) no tuvo efectos significativos sobre la Cmáx, Cmín y el AUCt de voriconazol. La administración de voriconazol no tuvo efectos significativos sobre la Cmáx y el AUCt de indinavir (800 mg tres veces al día). Efavirenz (inhibidor de la transcriptasa inversa no nucleósido) (inductor del CYP450; sustrato e inhibidor del CYP3A4): Dosis de efavirenz de 400 mg una vez al día o superiores y dosis estándar de voriconazol no deben ser coadministradas. Una vez alcanzado el estado estable en sujetos sanos (400 mg de efavirenz por vía oral una vez al día administrado concomitantemente con 200 mg de voriconazol dos veces al día), efavirenz disminuyó la Cmáx en estado estable y el AUCt de voriconazol en un promedio de 61% y 77%, respectivamente. En el mismo estudio, voriconazol, una vez alcanzado el estado estable en sujetos sanos aumentó la Cmáx en estado estable y el AUCt de efavirenz en un promedio de 38% y 44%, respectivamente. En un estudio independiente en voluntarios sanos, con dosis de 300 mg de voriconazol dos veces al día en combinación con dosis bajas de efavirenz (300 mg una vez al día) no se alcanzó una exposición suficiente a voriconazol. Tras la administración de 400 mg de voricozanol dos veces al día y 300 mg de efavirenz por vía oral una vez al día en voluntarios sanos, el AUCt de voriconazol disminuyó en un 7%, y la Cmáx se incrementó en un 23%, en comparación con los valores alcanzados cuando se administra 200 mg de voriconazol dos veces al día. (El AUCt de efavirenz aumentó en un 17% y la Cmáx fue equivalente en comparación con los valores alcanzados tras la administración de 600 mg de efavirenz una vez al día sin voriconazol). Estas diferencias no se consideraron clínicamente significativas. Cuando el voriconazol es coadministrado con el efavirenz, la dosis de mantenimiento del voriconazol debe aumentarse a 400 mg dos veces al día y la dosis de efavirenz debe reducirse en un 50%, por ejemplo, a 300 mg una vez al día. Cuando el tratamiento con voriconazol finalice, se restaurará la dosis inicial de efavirenz (ver Dosificación y Advertencias). Otros inhibidores de la proteasa del VIH (inhibidores del CYP3A4): Estudios in vitro sugieren que voriconazol puede inhibir el metabolismo de los inhibidores de la proteasa del VIH (p.ej.: saquinavir, amprenavir y nelfinavir). Los estudios in vitro también demuestran que los inhibidores de la proteasa del VIH pueden inhibir el metabolismo de voriconazol. Sin embargo, los resultados de la combinación de voriconazol con otros inhibidores de la proteasa del VIH pueden no ser predecibles en humanos sólo a partir de los estudios in vitro. Se debe controlar cuidadosamente a los pacientes por si apareciese toxicidad y/o pérdida de eficacia durante la administración concomitante de voriconazol e inhibidores de la proteasa del VIH. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN) (sustratos e inhibidores del CYP3A4, o inductores del CYP450): Estudios in vitro demuestran que delavirdina puede inhibir el metabolismo de voriconazol. Aunque no se ha estudiado, nevirapina puede inducir el metabolismo de voriconazol. Un estudio in vivo demostró que voriconazol inhibe el metabolismo de efavirenz. La administración de voriconazol puede también inhibir el metabolismo de los ITINN además de efavirenz. Debe controlarse cuidadosamente a los pacientes durante la administración concomitante de voriconazol e ITINN por si apareciese toxicidad y/o pérdida de eficacia. Carcinogénesis, mutagénesis y trastornos de la fertilidad: Estudios toxicológicos con dosis-repetidas de voriconazol indicaron que el hígado es el órgano diana de la toxicidad. La hepatotoxicidad ocurrió a exposiciones plasmáticas similares a las obtenidas con dosis terapéuticas en humanos, al igual que con otros fármacos antifúngicos. En ratas, ratones y perros, voriconazol indujo también cambios adrenales mínimos. Los estudios convencionales de seguridad farmacológica, genotoxicidad o potencial carcinogénico, no han revelado un riesgo especial para los humanos. En estudios de reproducción, voriconazol demostró ser teratogénico en ratas y embriotóxico en conejos con exposiciones sistémicas equivalentes a las obtenidas en humanos con dosis terapéuticas. En el estudio de desarrollo pre y postnatal en ratas expuestas a dosis más bajas que las terapéuticas en humanos, voriconazol prolongó la duración de la gestación y del parto y originó distocia, con la consecuente mortalidad materna y menor supervivencia perinatal de las crías. Los efectos sobre el parto están probablemente mediados por mecanismos específicos en cada especie, implicando reducción de los niveles de estradiol, y son consistentes con los observados con otros fármacos antifúngicos azólicos. Los datos preclínicos sobre el vehículo de la formulación intravenosa, la sulfobutiléter betaciclodextrina sódica (SBECD), indicaron que los principales efectos fueron la vacuolización del epitelio del tracto urinario y la activación de los macrófagos en hígado y pulmones, en los estudios de toxicidad a dosis repetidas. Como el resultado de la GPTM (prueba de maximización en cobaya para la detección de alérgenos por contacto), fue positivo, el médico debe tener en cuenta el potencial de hipersensibilidad a la formulación intravenosa. Los estudios estándares de genotoxicidad y los estudios de reproducción con el excipiente SBECD no revelaron la existencia de un riesgo especial para el hombre. No se realizaron estudios de carcinogenicidad con SBECD. Se ha demostrado que una impureza presente en el excipiente SBECD es un agente alquilante mutagénico, con evidencia de carcinogenicidad en roedores. Esta impureza debe ser considerada como una sustancia de potencial carcinogénico para el hombre. A la vista de estos datos, la duración del tratamiento con la presentación de administración por vía intravenosa no debe ser superior a 6 meses. Embarazo y lactancia: Embarazo: No se dispone de datos adecuados sobre la utilización de VFEND en mujeres embarazadas. Los estudios en animales han demostrado toxicidad sobre la reproducción. Se desconoce el posible riesgo en humanos. VFEND no debe utilizarse durante el embarazo a menos que los beneficios para la madre superen claramente a los riesgos potenciales para el feto. Mujeres en edad fértil: Las mujeres en edad fértil deben utilizar siempre métodos anticonceptivos eficaces durante el tratamiento. Lactancia: No se ha investigado la excreción de voriconazol en la leche materna. Debe interrumpirse la lactancia al comienzo del tratamiento con VFEND. Efectos sobre la capacidad para conducir y operar maquinarias: VFEND puede ejercer una influencia moderada sobre la capacidad para conducir y utilizar máquinas. La administración de voriconazol puede producir cambios transitorios y reversibles de la visión, incluyendo visión borrosa, percepción visual alterada/aumentada y/o fotofobia. Los pacientes deben evitar realizar tareas potencialmente peligrosas, como conducir o manejar maquinarias mientras presenten estos síntomas.
Conservación.
El polvo liofilizado se debe mantener a temperatura no mayor a 30°C. VFEND es un liofilizado estéril sin conservantes de dosis única. Por lo tanto, desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente una vez reconstituido. Si no se utiliza inmediatamente, el tiempo y condiciones de conservación antes de su utilización, son responsabilidad del usuario debiéndose mantener a 2-8°C (en refrigerador) durante un período máximo de 24 horas a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas. Se ha demostrado que la estabilidad química y física en uso es de 24 horas entre 2°C y 8°C. Concentrado reconstituido: Conservar entre 2-8°C hasta 24 horas (en refrigerador).
Sobredosificación.
En los ensayos clínicos hubo 3 casos de sobredosis accidental. Todos ocurrieron en niños, que recibieron hasta cinco veces la dosis intravenosa recomendada de voriconazol. Se comunicó un único evento adverso de fotofobia de 10 minutos de duración. No se conoce ningún antídoto frente a voriconazol. Voriconazol es hemodializado con un clearance de 121 ml/min. El excipiente intravenoso, ESBCD, es hemodializado con un clearance de 55 ml/min. En caso de sobredosis, la hemodiálisis puede contribuir a la eliminación de voriconazol y de ESBCD del organismo. Ante la eventualidad de una sobredosificación concurrir al Hospital más cercano o comunicarse a los Centros de Toxicología: Hospital de Pediatría Ricardo Gutiérrez: (011) 4962-6666/2247. Hospital A. Posadas (011) 4658-7777 / 4654-6648.
Presentación.
VFEND se presenta en envases que contienen 1 frasco ampolla de polvo liofilizado.
Revisión.
Septiembre 2018. LPD:23/Octubre/2015.
Laboratorio que comercializa Vfend
PFIZER →

