OPDIVO®
BRISTOL-M.S.
Anticuerpo monoclonal humano que bloquea la interacción entre PD-1 y sus ligandos, PD-L1 y PD-L2. Inmunoglobulina IgG4 kappa.
Descripción.
Nivolumab es un anticuerpo monoclonal humano que bloquea la interacción entre PD-1 y sus ligandos, PD-L1 y PD-L2. Nivolumab es una inmunoglobulina IgG4 kappa, cuya masa molecular se calcula en 146 kDa. OPDIVO es un líquido estéril, libre de conservantes, no pirogénico, de transparente a opalescente, entre incoloro y color amarillo pálido, que puede contener partículas livianas (pocas). OPDIVO inyectable para infusión intravenosa se presenta en viales para dosis única. Cada mililitro de solución de OPDIVO contiene nivolumab 10 mg, manitol (30 mg), ácido pentético (0,008 mg), polisorbato 80 (0,2 mg), cloruro de sodio (2,92 mg), citrato de sodio dihidrato (5,88 mg) y agua para uso inyectable, USP. Puede contener ácido clorhídrico y/o hidróxido de sodio para ajustar el pH a 6.
Composición.
OPDIVO (NIVOLUMAB) se suministra en frascos ampolla/viales de un solo uso de 40 mg/4 mL y 100 mg/10 mL. Cada frasco ampolla/vial de 10 mL contiene 100 mg de nivolumab y los siguientes excipientes: citrato de sodio dihidrato (62,9 mg), cloruro de sodio (31,2 mg), manitol (321 mg), ácido pentético (0,0856 mg), polisorbato 80 (2,14 mg), y agua para inyección. Para ajuste a pH 6: ácido clorhídrico y/o hidróxido de sodio c.s. Cada frasco ampolla/vial de 4 mL contiene 40 mg de nivolumab y los siguientes excipientes: citrato de sodio dihidrato (27,6 mg), cloruro de sodio (13,7 mg), manitol (141 mg), ácido pentético (0,0376 mg), polisorbato 80 (0,940 mg), y agua para inyección. Para ajuste a pH 6: ácido clorhídrico y/o hidróxido de sodio c.s.
Estudios clínicos.
Melanoma irresecable o metastásico. Melanoma metastásico previamente tratado: El Ensayo 1 fue un estudio multicéntrico, abierto, que randomizó (2:1) pacientes con melanoma irresecable o metastásico para recibir OPDIVO administrado por vía intravenosa a razón de 3 mg/kg cada 2 semanas o una quimioterapia a elección del investigador, ya sea el agente único dacarbazina 1000 mg/m2 cada 3 semanas o la combinación de carboplatino AUC 6 cada 3 semanas más paclitaxel 175 mg/m2 cada 3 semanas. Los pacientes debían tener progresión de la enfermedad durante o después del tratamiento con ipilimumab y, si eran positivos para la mutación BRAF V600, un inhibidor de BRAF. El ensayo excluyó a los pacientes con enfermedad autoinmune, afecciones médicas que requerían inmunosupresión sistémica, melanoma ocular, metástasis cerebral activa, o antecedentes de reacciones adversas de Grado 4 relacionadas con ipilimumab (excepto por endocrinopatías) o reacciones adversas de Grado 3 relacionadas con ipilimumab que no se habían resuelto o que estaban inadecuadamente controladas dentro de las 12 semanas de iniciado el evento. Se llevaron a cabo evaluaciones tumorales 9 semanas después de la randomización, luego cada 6 semanas durante el primer año, y cada 12 semanas de allí en más. La eficacia se evaluó en un análisis preliminar planeado de rama única, no comparativo, de los primeros 120 pacientes que recibieron OPDIVO en el Ensayo 1 y en quienes la duración mínima del seguimiento fue de 6 meses. Las medidas principales de los resultados de eficacia en esta población fueron la tasa de respuesta objetiva (ORR, por sus siglas en inglés) confirmada, según se mide por revisión central independiente bajo ciego usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST 1.1, por sus siglas en inglés) y la duración de la respuesta. Entre los 120 pacientes tratados con OPDIVO, la mediana de la edad fue de 58 años (rango: 25 a 88), el 65% de los pacientes eran de sexo masculino, el 98% eran de raza blanca, y el estado funcional (PS) ECOG era 0 (58%) o 1 (42%). Las características de la enfermedad eran enfermedad M1c (76%), positividad para mutación BRAF V600 (22%), nivel elevado de LDH (56%), antecedentes de metástasis cerebral (18%), y dos o más terapias sistémicas previas para la enfermedad metastásica (68%). La ORR fue del 32% (intervalo de confianza [IC] del 95%: 23, 41), consistente en 4 respuestas completas y 34 respuestas parciales en pacientes tratados con OPDIVO. De 38 pacientes con respuesta, 33 pacientes (87%) tenían respuestas en curso con duraciones que oscilaban entre 2,6+ y 10+ meses, que incluyeron a 13 pacientes con respuestas en curso de 6 meses o más. Hubo respuestas objetivas en pacientes con y sin melanoma positivo para la mutación BRAF V600. Melanoma metastásico no tratado previamente: Ensayo 4: El Ensayo 4 fue un ensayo multicéntrico, doble ciego, randomizado (1:1), realizado en pacientes con melanoma irresecable o metastásico sin mutación BRAF V600 (wild-type). Los pacientes fueron randomizados para recibir OPDIVO 3 mg/kg por infusión intravenosa cada 2 semanas o dacarbazina 1000 mg/m2 por infusión intravenosa cada 3 semanas hasta la progresión de la enfermedad o la aparición de una toxicidad inaceptable. La randomización se estratificó por estado PD-L1 (mayor o igual al 5% de tinción en membrana de células tumorales por inmunohistoquímica, versus menor al 5% o resultado indeterminado) y estadio M (M0/M1a/M1b versus M1c). Los criterios de elegibilidad clave incluyeron melanoma cutáneo, de mucosa o acral irresecable o metastásico histológicamente confirmado; ausencia de terapia previa para la enfermedad metastásica; finalización de la terapia adyuvante o neoadyuvante previa al menos 6 semanas antes de la randomización; estado funcional ECOG 0 o 1; ausencia de enfermedad autoinmune; y ausencia de metástasis cerebrales o leptomeníngeas activas. El ensayo excluyó a pacientes con melanoma ocular. Las evaluaciones tumorales se realizaron 9 semanas después de la randomización, luego cada 6 semanas durante el primer año y después cada 12 semanas de allí en adelante. El principal criterio de valoración de la eficacia fue la sobrevida global (OS, por sus siglas en inglés). Las mediciones adicionales de resultados incluyeron la sobrevida libre de progresión (PFS, por sus siglas en inglés) y la tasa de respuesta objetiva (ORR, por sus siglas en inglés) evaluadas por el investigador según los criterios RECIST v1.1. Un total de 418 pacientes fueron randomizados a OPDIVO (n=210) o dacarbazina (n=208). La mediana de la edad fue de 65 años (rango: 18 a 87), el 59% eran hombres, y el 99,5% eran de raza blanca. Las características de la enfermedad fueron enfermedad en estadio M1c (61%), melanoma cutáneo (74%), melanoma de mucosa (11%), nivel elevado de LDH (37%), PD-L1 mayor o igual al 5% de expresión en membrana de células tumorales (35%) y antecedentes de metástasis cerebral (4%). Más pacientes en la rama de OPDIVO tuvieron un estado funcional ECOG de 0 (71% versus 58%). El Ensayo 4 demostró una mejora estadísticamente significativa en la OS para la rama de OPDIVO en comparación con la rama de dacarbazina en un análisis preliminar basado en el 47% de los eventos planeados totales para OS. La Tabla 16 y la Figura 1 sintetizan los resultados de eficacia.
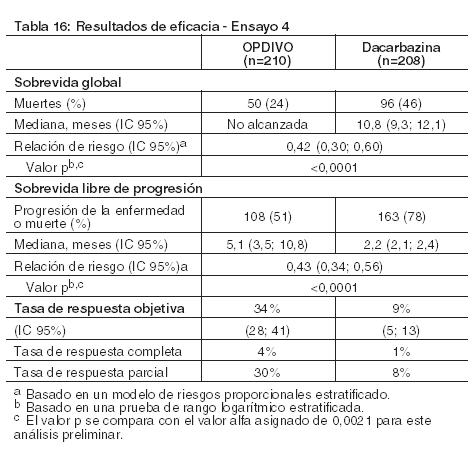
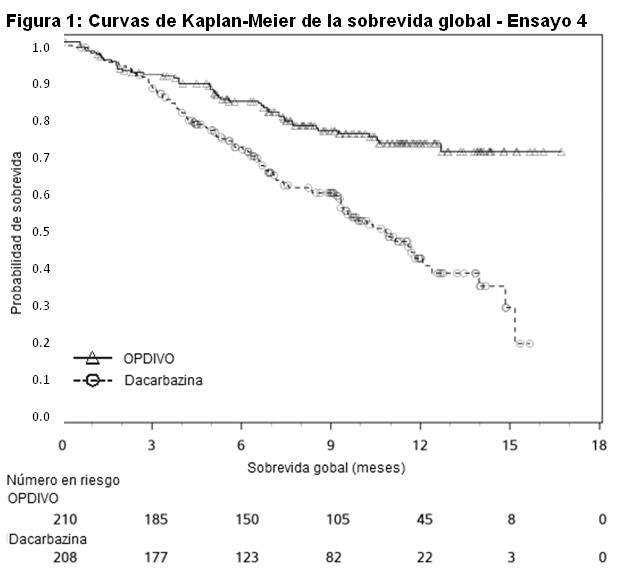
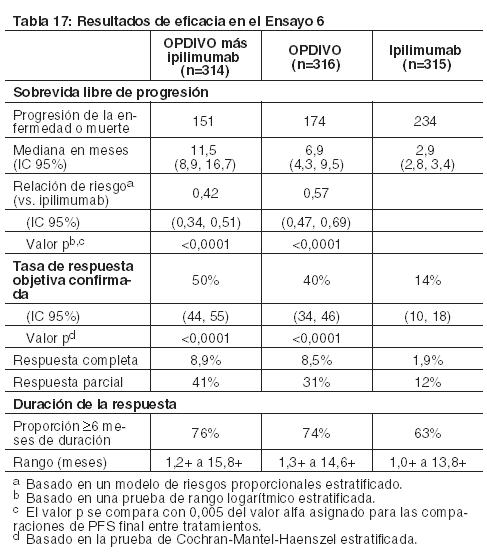
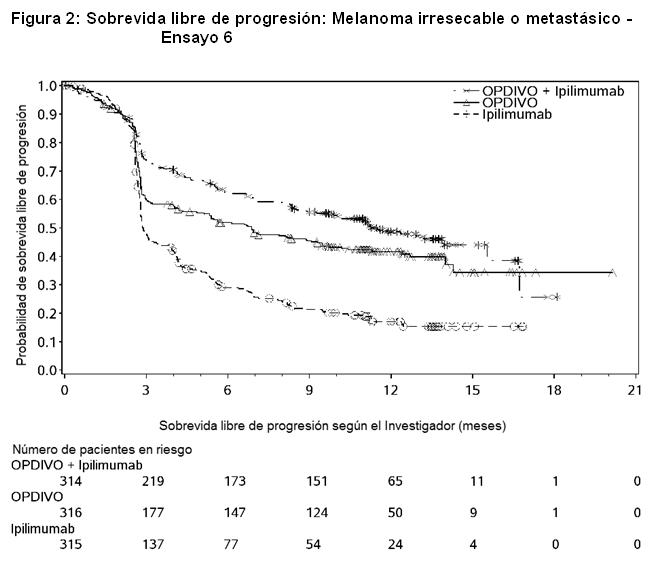
Al momento del análisis, el 88% (63/72) de los pacientes tratados con OPDIVO tenían respuestas en curso, incluidos 43 pacientes con respuestas en curso de 6 meses o más. Ensayo 6: El Ensayo 6 fue un estudio multicéntrico, a doble ciego, que randomizó (1:1:1) pacientes con melanoma irresecable o metastásico no tratado previamente a una de las siguientes ramas: OPDIVO más ipilimumab, OPDIVO, o ipilimumab. Los pacientes debían haber completado el tratamiento adyuvante o neoadyuvante al menos 6 semanas antes de la randomización, no haber sido tratados antes con un anticuerpo anti-CTLA-4, y no presentar evidencia de metástasis cerebral activa, melanoma ocular, enfermedad autoinmune o afecciones médicas que requirieran inmunosupresión sistémica. Los pacientes fueron randomizados para recibir: OPDIVO 1 mg/kg con ipilimumab 3 mg/kg cada 3 semanas por 4 dosis, seguido por OPDIVO 3 mg/kg como monoterapia cada 2 semanas (rama de OPDIVO más ipilimumab), OPDIVO 3 mg/kg cada 2 semanas (rama de OPDIVO), o Ipilimumab 3 mg/kg cada 3 semanas por 4 dosis, seguido por placebo cada 2 semanas (rama de ipilimumab). La randomización fue estratificada por expresión de PD-L1 (≥ 5% vs. < 5% de expresión en membrana celular tumoral) según se determina mediante un ensayo clínico, estado de mutación BRAF V600, y estadio M según el sistema de estadificación del Comité Conjunto Estadounidense sobre Cáncer (AJCC) (M0, M1a, M1b vs. M1c). Las evaluaciones tumorales se realizaron 12 semanas después de la randomización, luego cada 6 semanas durante el primer año, y cada 12 semanas de allí en adelante. Las mediciones de resultados de eficacia principales fueron la PFS evaluada por el investigador según los criterios RECIST v1.1 y la OS. Las mediciones de resultados de eficacia adicionales fueron la ORR confirmada y la duración de la respuesta. Un total de 945 pacientes fueron randomizados: 314 pacientes a la rama de OPDIVO más ipilimumab, 316 a la rama de OPDIVO y 315 a la rama de ipilimumab. Las características de la población del ensayo fueron las siguientes: mediana de edad 61 años (rango: 18 a 90); 65% de sexo masculino; 97% de raza blanca; estado funcional ECOG de 0 (73%) o 1 (27%). Las características de la enfermedad fueron: enfermedad en Estadio IV AJCC (93%); enfermedad M1c (58%); nivel elevado de LDH (36%); antecedentes de metástasis cerebral (4%); melanoma positivo para mutación BRAF V600 (32%); PD-L1≥ 5% de expresión en membrana celular tumoral según se determina por ensayo clínico (46%); y terapia adyuvante previa (22%). El Ensayo 6 demostró mejoras estadísticamente significativas en la PFS para los pacientes randomizados a cualquiera de las ramas que contenían OPDIVO en comparación con la rama de ipilimumab. Los resultados de eficacia se presentan en la Tabla 17 y la Figura 2.
Las Figuras 3 y 4 presentan análisis exploratorios de eficacia por subgrupos de la PFS sobre la base de niveles de expresión definidos de PD-L1 determinados en muestras tumorales de archivo usando el ensayo PD-L1 IHC 28-8 pharmDx. Las muestras tumorales estuvieron disponibles para la evaluación retrospectiva en el 97% de la población del estudio; el estado de expresión de PD-L1 se determinó para el 89% de la población del estudio, mientras que en el 6% de los pacientes, la melanina impidió la evaluación del estado de expresión de PD-L1. El estado de expresión de PD-L1 fue desconocido para el 5% de la población del estudio debido al retiro del consentimiento o a muestras faltantes.
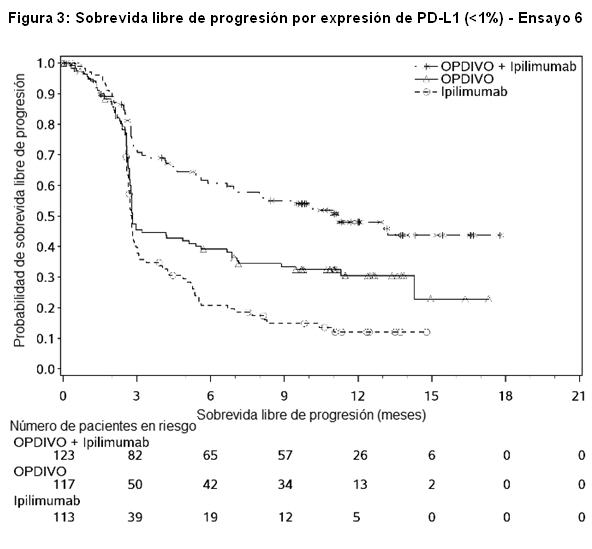
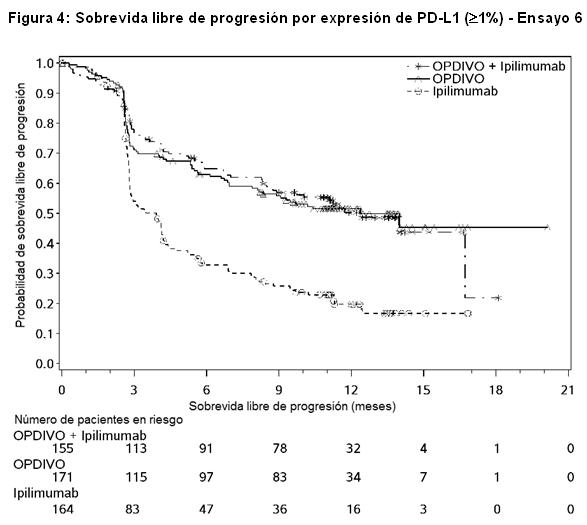
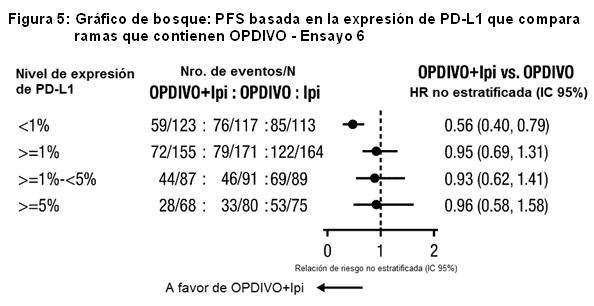
Los datos presentados en la figura a continuación sintetizan los resultados de análisis exploratorios que comparan las dos ramas que contienen OPDIVO en subgrupos definidos por expresión tumoral de PD-L1.
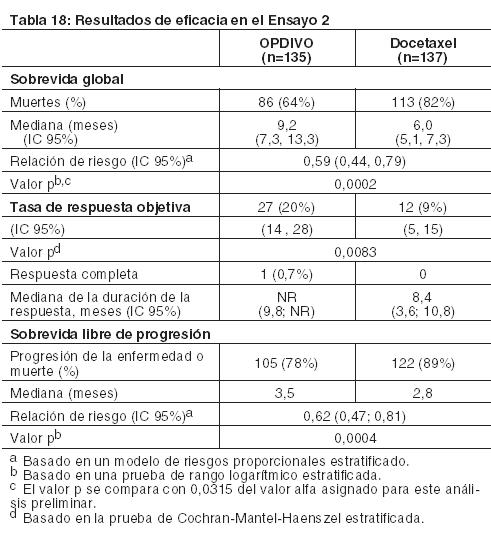
Cáncer de pulmón metastásico de células no pequeñas (NSCLC): Tratamiento de segunda línea del NSCLC escamoso metastásico: El Ensayo 2 fue un estudio randomizado (1:1), abierto, que enroló a 272 pacientes con NSCLC escamoso metastásico que habían experimentado progresión de la enfermedad durante o después de un régimen de quimioterapia dual previo basado en platino. Los pacientes recibieron OPDIVO (n=135) administrado por vía intravenosa a razón de 3 mg/kg cada 2 semanas o docetaxel (n=137) administrado por vía intravenosa a razón de 75 mg/m2 cada 3 semanas. La randomización se estratificó por tratamiento previo con paclitaxel versus otro tratamiento previo, y por región (EE.UU./Canadá versus Europa versus Resto del Mundo). Este estudio incluyó pacientes independientemente de su estado PD-L1. El ensayo excluyó pacientes con enfermedad autoinmune, afecciones médicas que requirieran inmunosupresión sistémica, enfermedad pulmonar intersticial sintomática o metástasis cerebral no tratada. Los pacientes con metástasis cerebral tratada eran elegibles si retornaban al estado neurológico basal al menos 2 semanas antes del enrolamiento, y no estaban recibiendo corticosteroides, o se encontraban con una dosis estable o en disminución de < 10 mg de equivalentes de prednisona por día. Las primeras evaluaciones tumorales se llevaron a cabo 9 semanas después de la randomización y continuaron cada 6 semanas de allí en adelante. La medición del resultado de eficacia principal fue la sobrevida global (OS). Las mediciones adicionales de los resultados de eficacia fueron la ORR y la PFS evaluadas por el investigador. En el Ensayo 2, la mediana de la edad fue de 63 años (rango: 39 a 85), con un 44% de ≥65 años de edad y un 11% de ≥75 años de edad. La mayoría de los pacientes era de raza blanca (93%) y sexo masculino (76%); la mayoría de los pacientes fueron enrolados en Europa (57%), y los restantes en EE.UU./Canadá (32%) y el resto del mundo (11%). El estado funcional ECOG en condición basal fue 0 (24%) o 1 (76%), y el 92% de los pacientes eran exfumadores/ fumadores actuales. Las características basales de la enfermedad de la población según reportaron los investigadores fueron Estadio IIIb (19%), Estadio IV (80%) y metástasis cerebrales (6%). Todos los pacientes recibieron terapia previa con un régimen dual basado en platino, y el 99% de los pacientes tenían tumores con histología de células escamosas. El ensayo demostró una mejora estadísticamente significativa en la OS para los pacientes randomizados a OPDIVO en comparación con docetaxel en el análisis preliminar preespecificado cuando se observaron 199 eventos (el 86% de la cantidad planeada de eventos para el análisis final) (Tabla 18 y Figura 6).
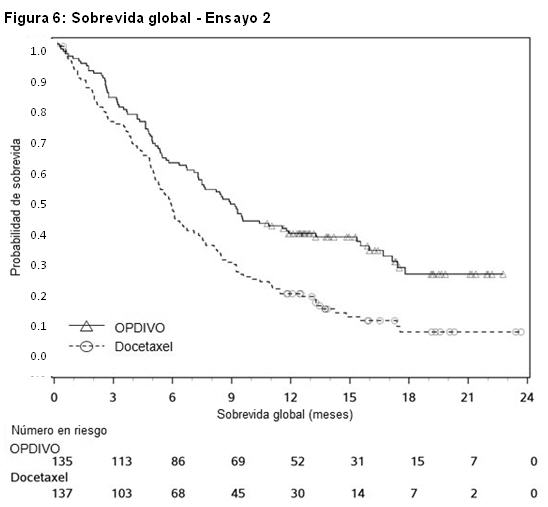
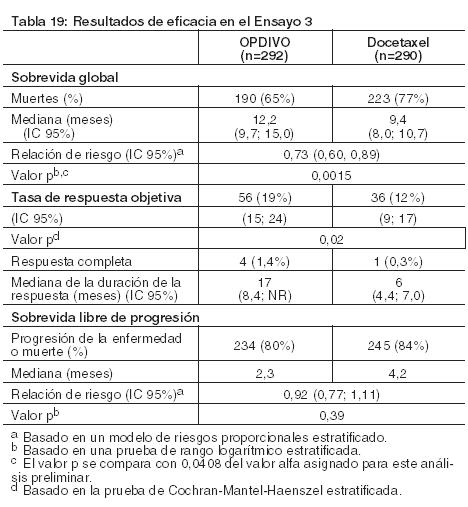
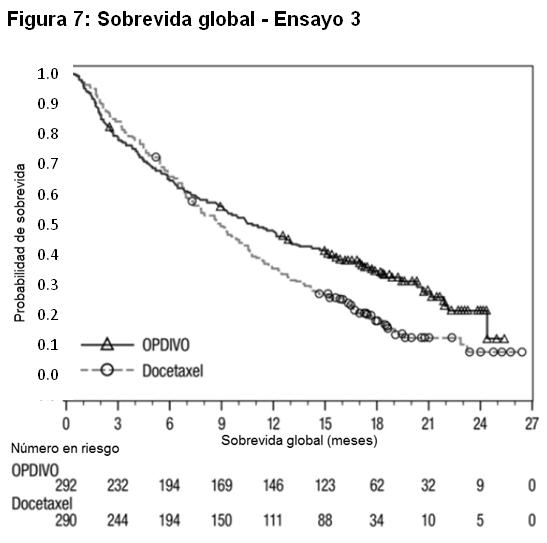
Las muestras tumorales de archivo fueron evaluadas retrospectivamente en cuanto a la expresión de PD-L1. En toda la población del estudio, el 17% (47/272) de los pacientes tuvieron resultados no cuantificables. Entre los 225 pacientes con resultados cuantificables, el 47% (106/225) tuvieron NSCLC de células escamosas PD-L1 negativo, definido como < 1% de células tumorales que expresaban PD-L1, y el 53% (119/225) tuvieron NSCLC de células escamosas PD-L1 positivo, definido como ≥ 1 de células tumorales que expresaban PD-L1. En los análisis exploratorios preespecificados por subgrupos, las relaciones de riesgo para sobrevida fueron 0,58 (IC 95%: 0,37; 0,92) en el subgrupo PD-L1 negativo y 0,69 (IC 95%: 0,45; 1,05) en el subgrupo de NSCLC PD-L1 positivo. Tratamiento de segunda línea del NSCLC no escamoso metastásico: El Ensayo 3 fue un estudio randomizado (1:1), de diseño abierto, de 582 pacientes con NSCLC no escamoso metastásico, que habían experimentado progresión de la enfermedad durante o después de un régimen de quimioterapia dual previo basado en platino. Se permitió una terapia dirigida previa apropiada en pacientes con mutación EGFR sensibilizante conocida o translocación de ALK. Los pacientes recibieron OPDIVO (n=292) administrado por vía intravenosa a razón de 3 mg/kg cada 2 semanas o docetaxel (n=290) administrado por vía intravenosa a razón de 75 mg/m2 cada 3 semanas. La randomización fue estratificada por terapia de mantenimiento previa (sí versus no) y número de terapias previas (1 versus 2). El ensayo excluyó a pacientes con enfermedad autoinmune, afecciones médicas que requirieran inmunosupresión sistémica, enfermedad pulmonar intersticial sintomática o metástasis cerebral no tratada. Los pacientes con metástasis cerebral tratada fueron elegibles si eran neurológicamente estables. Las primeras evaluaciones tumorales se llevaron a cabo 9 semanas después de la randomización y continuaron cada 6 semanas de allí en adelante. La principal medición del resultado de eficacia fue la sobrevida global (OS). Las mediciones adicionales del resultado de eficacia fueron la tasa de respuesta objetiva (ORR) y la sobrevida libre de progresión (PFS) evaluadas por el investigador. Asimismo, se llevaron a cabo análisis preespecificados en subgrupos definidos por la expresión de PD-L1. En el Ensayo 3, la mediana de la edad fue de 62 años (rango: 21 a 85), con el 42% de los pacientes ≥65 años y el 7% de los pacientes ≥75 años. La mayoría de los pacientes eran de raza blanca (92%) y sexo masculino (55%); la mayoría de los pacientes fueron enrolados en Europa (46%), seguida por EE.UU./Canadá (37%) y el resto del mundo (17%). El estado funcional ECOG basal fue 0 (31%) o 1 (69%), el 79% eran ex-fumadores o fumadores actuales, el 3,6% tenía NSCLC con redisposición de ALK, el 14% tenía NSCLC con mutación EGFR, y el 12% tenía metástasis cerebral previamente tratada. La terapia previa incluyó un régimen dual basado en platino (100%), y el 40% recibió terapia de mantenimiento como parte del régimen de primera línea. Los subtipos histológicos incluyeron adenocarcinoma (93%), de células grandes (2,4%) y broncoalveolar (0,9%). El Ensayo 3 demostró una mejora estadísticamente significativa en la OS para los pacientes randomizados a OPDIVO en comparación con docetaxel en el análisis preliminar preespecificado, cuando se observaron 413 eventos (93% del número planeado de eventos para el análisis final) (Tabla 19 y Figura 7).
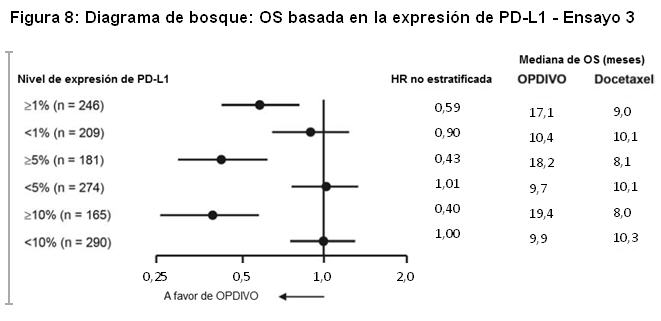
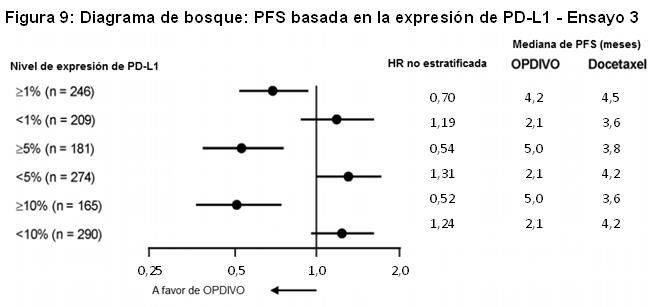
Las muestras tumorales de archivo fueron evaluadas en cuanto a la expresión de PD-L1 tras completar el ensayo. En toda la población de estudio, el 22% (127/582) de los pacientes tuvieron resultados no cuantificables. De los 455 pacientes restantes, la proporción de pacientes en subgrupos determinados retrospectivamente sobre la base del análisis de PD-L1 usando el ensayo PD-L1 IHC 28-8 pharmDx fueron: 46% (209/455) PD-L1 negativos, definidos como < 1% de células tumorales que expresan PD-L1, y 54% (246/455) con expresión de PD-L1, definidos como ≥1% de células tumorales que expresan PD-L1. Entre los 246 pacientes con tumores que expresan PD-L1, el 26% (65/246) tenía ≥1%, pero < 5% de células tumorales con tinción positiva, el 7% (16/246) tenía ≥5% pero < 10% de células tumorales con tinción positiva, y el 67% (165/246) tenía un porcentaje mayor o igual al 10% de células tumorales con tinción positiva. La Figura 8 resume los resultados de análisis preespecificados de la sobrevida en subgrupos determinados por el porcentaje de células tumorales que expresan PD-L1. La Figura 9 resume los resultados de análisis preespecificados de la sobrevida libre de progresión en subgrupos determinados por el porcentaje de células tumorales que expresan PD-L1.
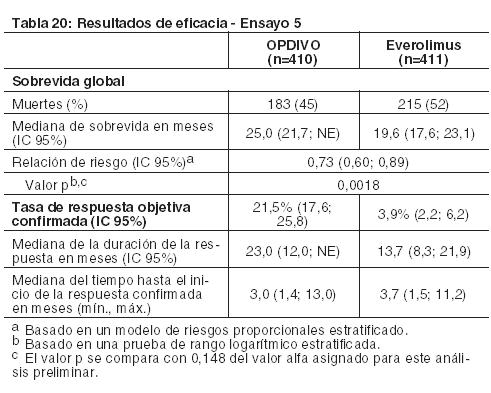
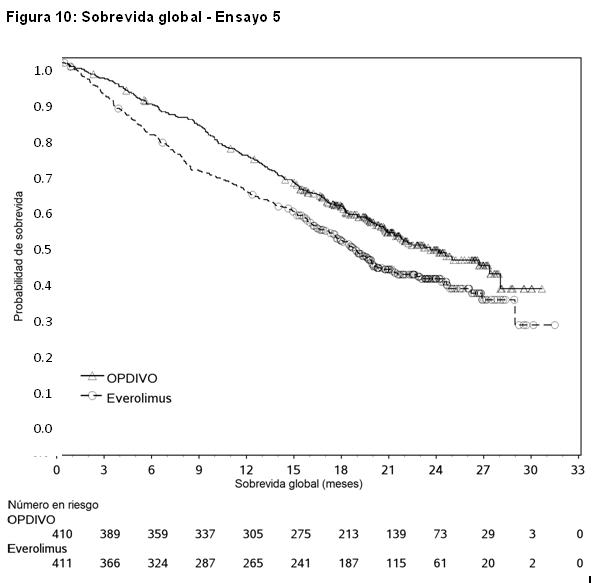
Carcinoma de células renales: El Ensayo 5 fue un estudio randomizado (1:1), de diseño abierto, en pacientes con RCC avanzado que experimentaron progresión de la enfermedad durante o después de uno o dos regímenes de terapia anti-angiogénica previa. Los pacientes debían tener un puntaje de rendimiento de Karnofsky (KPS) ≥ 70%, y fueron incluidos independientemente de su estado PD-L1. El Ensayo 5 excluyó a pacientes con cualquier antecedente o cuadro concurrente de metástasis cerebral, tratamiento previo con un inhibidor de mTOR, enfermedad autoinmune activa o afección médica que requiriera inmunosupresión sistémica. Los pacientes fueron estratificados por región, grupo de riesgo según el Memorial Sloan Kettering Cancer Center (MSKCC) y número de terapias anti-angiogénicas previas. Los pacientes fueron randomizados a OPDIVO (n=410) administrado por vía intravenosa a razón de 3 mg/kg cada 2 semanas o everolimus (n=411) administrado por vía oral a razón de 10 mg por día. La mediana de la edad fue de 62 años (rango: 18 a 88), con un 40% ≥ 65 años de edad y un 9% ≥ 75 años de edad. La mayoría de los pacientes eran de sexo masculino (75%) y raza blanca (88%), y el 34% y 66% de los pacientes tenían un KPS basal del 70% al 80% y del 90% al 100%, respectivamente. La mayoría de los pacientes (77%) fueron tratados con una terapia anti-angiogénica previa. La distribución de pacientes por grupos de riesgo MSKCC fue 34% favorable, 47% intermedio y 19% malo. Las primeras evaluaciones tumorales se llevaron a cabo 8 semanas después de la randomización y continuaron cada 8 semanas de allí en adelante durante el primer año y luego cada 12 semanas hasta la progresión o la discontinuación del tratamiento, lo que sucediera más tarde. El principal criterio de valoración de la eficacia fue la sobrevida global (OS). El ensayo demostró una mejora estadísticamente significativa en la OS para los pacientes randomizados a OPDIVO en comparación con everolimus en el análisis preliminar preespecificado cuando se observaron 398 eventos (el 70% del número planeado de eventos para el análisis final) (Tabla 18 y Figura 10). El beneficio de la OS se observó independientemente del nivel de expresión de PD-L1. Otros criterios de valoración incluyen las tasas de respuesta objetiva confirmada, que también se presentan en la Tabla 20.
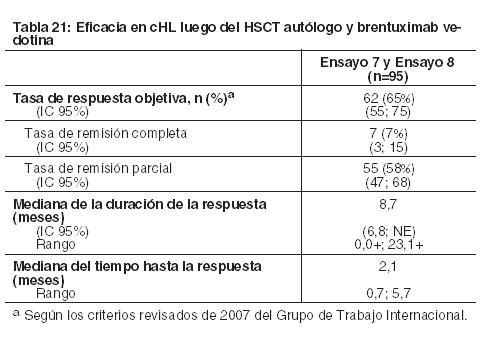
Linfoma de Hodgkin clásico: Dos estudios evaluaron la eficacia de OPDIVO como agente único en pacientes con cHL luego del fracaso del HSCT autólogo y de tratamiento con brentuximab vedotina post-trasplante. El Ensayo 7 fue un estudio de rama única, diseño abierto, multicéntrico y múltiples cohortes realizado en cHL. El Ensayo 8 fue un estudio de diseño abierto, multicéntrico, de escalación de dosis, que incluyó cHL. Ambos estudios incluyeron pacientes independientemente de su estado PD-L1 tumoral, y excluyeron pacientes con un estado funcional ECOG de 2 o más, enfermedad autoinmune, enfermedad pulmonar intersticial sintomática, transaminasas hepáticas en un nivel de más de 3 veces el límite superior del rango normal (ULN), clearance de creatinina inferior a 40 mL/min, HSCT alogénico previo, o irradiación de tórax dentro de las 24 semanas previas. Asimismo, ambos estudios requirieron una capacidad de difusión ajustada de los pulmones para monóxido de carbono (DLCO) de más del 60% en pacientes con toxicidad pulmonar previa. Los pacientes recibieron 3 mg/kg de OPDIVO administrado por vía intravenosa durante 60 minutos cada 2 semanas hasta la progresión de la enfermedad, el máximo beneficio clínico o una toxicidad inaceptable. Un ciclo consistió en una dosis. No se permitió la reducción de dosis. La eficacia fue evaluada por la tasa de respuesta objetiva (ORR), según la determinación de un comité independiente de revisión radiográfica (IRRC). Las mediciones de resultados adicionales incluyeron la duración de la respuesta. La eficacia fue evaluada en 95 pacientes en los Ensayos 7 y 8 combinados, quienes habían recibido brentuximab vedotina tras el fracaso del HSCT autólogo. La mediana de la edad fue de 37 años (rango: 18 a 72). La mayoría de los pacientes eran de sexo masculino (64%) y raza blanca (87%). Los pacientes habían recibido una mediana de 5 regímenes sistémicos previos (rango: 3 a 15). Los resultados se muestran en la Tabla 21. Los pacientes recibieron una mediana de 17 dosis de OPDIVO (rango: 3 a 48), con una mediana de la duración de la terapia de 8,3 meses (rango: 1,9 a 24 meses).
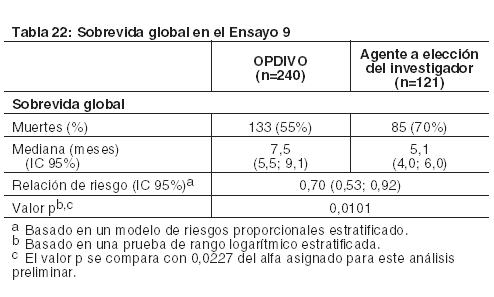
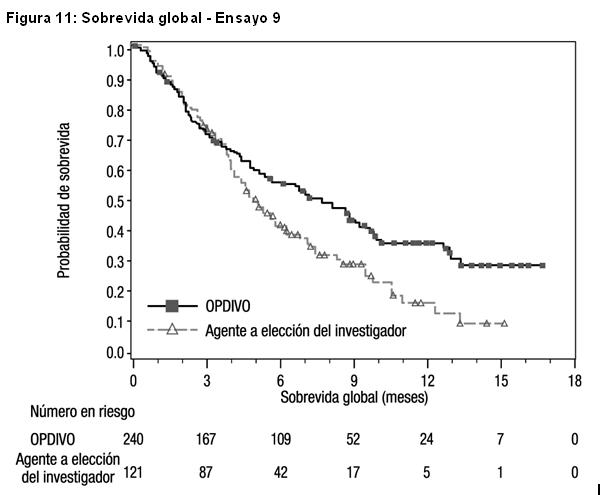
Carcinoma metastásico o recurrente de células escamosas de cabeza y cuello (SCCHN): El Ensayo 9 fue un estudio randomizado (2:1), con control activo, abierto, que enroló pacientes con SCCHN metastásico o recurrente que habían experimentado progresión de la enfermedad durante o dentro de los 6 meses después de recibir una terapia previa basada en platino administrada en el entorno adyuvante, neoadyuvante, primario (irresecable localmente avanzado) o metastásico. El ensayo excluyó a pacientes con enfermedad autoinmune, afecciones médicas que requirieran inmunosupresión, carcinoma recurrente o metastásico de nasofaringe, carcinoma de células escamosas de histología primaria desconocida, de glándulas salivales o de histologías no escamosas (por ejemplo, melanoma de mucosa), o con metástasis cerebral no tratada. Los pacientes con metástasis cerebral tratada eran elegibles si presentaban una condición neurológica estable. Los pacientes fueron randomizados para recibir OPDIVO administrado por vía intravenosa (IV) en una dosis de 3 mg/kg cada 2 semanas, o un agente a elección del investigador: una dosis de carga IV de cetuximab 400 mg/m2, seguida por 250 mg/m2 semanalmente, metotrexato de 40 a 60 mg/m2 por vía IV semanalmente, o docetaxel de 30 a 40 mg/m2 por vía IV semanalmente. La randomización se estratificó por tratamiento previo con cetuximab (sí/no). Las primeras evaluaciones tumorales se llevaron a cabo 9 semanas después de la randomización y continuaron cada 6 semanas de allí en adelante. La principal medición de resultados de eficacia fue la OS. Las mediciones adicionales de los resultados de eficacia fueron la PFS y la ORR. En el Ensayo 9, un total de 361 pacientes fueron randomizados: 240 pacientes para recibir OPDIVO y 121 pacientes para recibir el agente a elección del investigador (el 45% recibieron docetaxel, el 43% recibieron metotrexato y el 12% recibieron cetuximab). La mediana de la edad fue de 60 años (rango: 28 a 83), con un 31% ≥ 65 años de edad; 83% eran blancos, 12% eran asiáticos y 4% eran negros; y 83% de sexo masculino. El estado funcional ECOG en condición basal fue 0 (20%) o 1 (78%); el 76% eran exfumadores o fumadores actuales, el 90% tenían enfermedad en Estadio IV; el 45% de los pacientes recibieron sólo una línea de terapia sistémica previa, mientras que el 55% restante recibió dos o más líneas de terapia sistémica previa; el 25% tenía tumores HPV p16 positivos, el 24% tenía tumores HPV p16 negativos, y el 51% tenía estado desconocido. El ensayo demostró una mejoría estadísticamente significativa en la OS para pacientes randomizados a OPDIVO en comparación con el agente a elección del investigador en un análisis preliminar especificado previamente (78% del número previsto de eventos para el análisis final). Los resultados se sobrevida se muestran en la Tabla 22 y la Figura 11. No hubo diferencias estadísticamente significativas entre ambas ramas para la PFS (HR=0,89; IC 95%: 0,70; 1,13) o la ORR (13,3% [IC 95%: 9,3; 18,3] versus 5,8% [IC 95%: 2,4; 11,6] para nivolumab y el agente a elección del investigador, respectivamente).
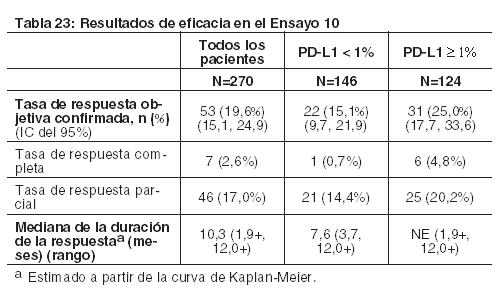
Las muestras tumorales de archivo fueron evaluadas retrospectivamente en cuanto a la expresión de PD-L1 usando el ensayo PD-L1 IHC 28-8 pharmDx. En toda la población de estudio, el 28% (101/361) de los pacientes tuvieron resultados no cuantificables. Entre los 260 pacientes con resultados cuantificables, el 43% (111/260) tuvieron SCCHN PD-L1 negativo, definido como < 1% de células tumorales que expresaban PD-L1, y el 57% (149/260) tuvieron SCCHN PD-L1 positivo, definido como ≥ 1% de células tumorales que expresaban PD-L1. En análisis exploratorios preespecificados por subgrupos, la relación de riesgo para la sobrevida fue de 0,89 (IC 95%: 0,54; 1,45), con medianas de sobrevida de 5,7 y 5,8 meses para las ramas de nivolumab y quimioterapia, respectivamente, en el subgrupo PD-L1 negativo. La HR para la sobrevida fue de 0,55 (IC 95%: 0,36; 0,83), con medianas de sobrevida de 8,7 y 4,6 meses para las ramas de nivolumab y quimioterapia, respectivamente, en el subgrupo de SCCHN PD-L1 positivo. Carcinoma urotelial: En el Ensayo 10, 270 pacientes con carcinoma urotelial localmente avanzado o metastásico que tuvieron progresión de la enfermedad durante o después de quimioterapia basada en platino o que tuvieron progresión de la enfermedad dentro de los 12 meses del tratamiento con un régimen de quimioterapia neoadyuvante o adyuvante basada en platino fueron tratados con OPDIVO. Se excluyó a pacientes con metástasis cerebral o leptomeníngea activa, enfermedad autoinmune activa, afecciones médicas que requirieran inmunosupresión sistémica y estado funcional ECOG > 1. Los pacientes recibieron una infusión intravenosa de 3 mg/kg de OPDIVO cada 2 semanas hasta la aparición de una toxicidad inaceptable o progresión radiográfica o clínica. Se llevaron a cabo evaluaciones de la respuesta tumoral cada 8 semanas durante las primeras 48 semanas y luego cada 12 semanas de allí en adelante. Las principales mediciones de resultados de eficacia incluyeron la tasa de respuesta objetiva (ORR) confirmada según evaluó un comité independiente de revisión radiográfica (IRRC) usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST v1.1) y la duración de la respuesta (DOR). La mediana de la edad fue de 66 años (rango de 38 a 90), el 78% eran varones, y el 86% de los pacientes eran de raza blanca. El 27% tenía carcinoma urotelial distinto de vejiga, y el 84% tenía metástasis visceral. El 34% de los pacientes tenían progresión de la enfermedad luego de una terapia neoadyuvante o adyuvante previa que contenía platino. El 29% de los pacientes habían recibido ≥2 regímenes sistémicos previos en el entorno metastásico. El 36% de los pacientes recibieron cisplatino previo solamente, el 23% recibieron carboplatino previo solamente, y el 7% fueron tratados con cisplatino y carboplatino en el entorno metastásico. El 46% de los pacientes tenían un estado funcional ECOG de 1. El 18% de los pacientes tenían un nivel de hemoglobina < 10 g/dl, y el 28% de los pacientes tenían metástasis hepática en condición basal. Los pacientes fueron incluidos independientemente de su estado de PD-L1. Las muestras tumorales fueron evaluadas prospectivamente usando el ensayo PD-L1 IHC 28-8 pharmDx en un laboratorio central, y los resultados se usaron para definir subgrupos para los análisis preespecificados. De los 270 pacientes, el 46% se definieron como con expresión de PD-L1 ≥1% (definida como ≥1% de células tumorales que expresan PD-L1). El restante 54% de los pacientes fueron clasificados como con expresión de PD-L1 < 1% (definida como < 1% de células tumorales que expresan PD-L1). La ORR confirmada en todos los pacientes y los dos subgrupos de PD-L1 se sintetizan en la Tabla 23. La mediana del tiempo hasta la respuesta fue de 1,9 meses (rango: 1,6-7,2). En 77 pacientes que recibieron terapia sistémica previa solamente en el entorno neoadyuvante o adyuvante, la ORR fue del 23,4% (IC del 95%: 14,5%; 34,4%).
Farmacología.
Mecanismo de acción: La unión de los ligandos de PD-1, PD-L1 y PD-L2, al receptor de PD-1 hallado en las células T inhibe la proliferación de células T y la producción de citoquinas. En algunos tumores se produce la sobrerregulación de los ligandos de PD-1, y la señalización a través de esta vía puede contribuir a la inhibición de la vigilancia inmunológica activa de células T de los tumores. Nivolumab es un anticuerpo monoclonal humano de inmunoglobulina G4 (IgG4) que se une al receptor de PD-1 y bloquea su interacción con PD-L1 y PD-L2, liberando la inhibición mediada por la vía de PD-1 de la respuesta inmune, incluida la respuesta inmune anti-tumoral. En modelos de tumor en ratones singénicos, el bloqueo de la actividad de PD-1 dio como resultado una disminución del crecimiento tumoral. La inhibición mediada por la combinación de nivolumab (anti-PD-1) e ipilimumab (anti-CTLA-4) da por resultado una mejor función de las células T, que es mayor que los efectos de cualquiera de los anticuerpos solo, y causa mejores respuestas antitumorales en el melanoma metastásico. En modelos de tumor singénico murino, el bloqueo dual de PD-1 y CTLA-4 dio como resultado una mayor actividad antitumoral. Farmacodinamia: Sobre la base de las relaciones de eficacia y seguridad de dosis/exposición, no hubo diferencias clínicamente significativas en la seguridad ni en la eficacia entre una dosis de nivolumab de 240 mg o 3 mg/kg cada 2 semanas en pacientes con melanoma, NSCLC, RCC y carcinoma urotelial. Farmacocinética: La farmacocinética (PK) de nivolumab fue evaluada usando un enfoque de PK poblacional tanto para OPDIVO como monoterapia como para OPDIVO con ipilimumab. OPDIVO como monoterapia: La PK de nivolumab como monoterapia fue estudiada en pacientes dentro de un rango de dosis de 0,1 a 20 mg/kg administrados en forma de dosis única o de dosis múltiples de OPDIVO cada 2 o 3 semanas. El clearance de nivolumab disminuye en el tiempo, con una reducción máxima media (% de coeficiente de variación [CV%]) respecto de los valores basales de aproximadamente 24,5% (47,6%), que resulta en un clearance en estado estacionario (CLss) por media geométrica (CV%) de 8,2 ml/h (53,9%); la disminución del CLss no se considera clínicamente relevante. El volumen de distribución por media geométrica en estado estacionario (Vss) (CV%) es de 6,8 L (27,3%), y la vida media de eliminación por media geométrica (t1/2) es de 25 días (77,5%). Las concentraciones de nivolumab en estado estacionario se alcanzaron a las 12 semanas aproximadamente cuando el fármaco se administró a razón de 3 mg/kg cada 2 semanas, y la acumulación sistémica fue de aproximadamente 3,7 veces. La exposición a nivolumab aumentó de manera proporcional a la dosis dentro del rango de dosis de 0,1 a 10 mg/kg administrados cada 2 semanas. OPDIVO con ipilimumab: El CL por media geométrica (CV%), el Vss y la vida media terminal de nivolumab fueron 10,0 ml/h (50,3%), 7,92 L (30,1%) y 24,8 días (94,3%), respectivamente. Cuando se administró en combinación, el CL de nivolumab aumentó un 24%, mientras que no hubo efecto sobre el clearance de ipilimumab. Cuando se administró en combinación, el clearance de nivolumab aumentó un 42% en presencia de anticuerpos anti-nivolumab. No hubo efecto de los anticuerpos anti-ipilimumab sobre el clearance de ipilimumab. Poblaciones específicas: El análisis de PK poblacional sugirió que los siguientes factores no tenían un efecto clínicamente importante sobre el clearance de nivolumab: edad (29 a 87 años), peso (35 a 160 kg), género, raza, LDH basal, expresión de PD-L1, tipo de tumor sólido, tamaño del tumor, deterioro renal y deterioro hepático leve. Deterioro renal: El efecto del deterioro renal sobre el clearance de nivolumab fue evaluado por un análisis de PK poblacional en pacientes con deterioro renal leve (eGFR 60 a 89 mL/min/1,73 m2; n=313), moderado (eGFR 30 a 59 mL/min/1,73 m2; n=140) o severo (eGFR 15 a 29 mL/min/1,73 m2; n=3). No se observaron diferencias clínicamente importantes en el clearance de nivolumab entre pacientes con deterioro renal y pacientes con función renal normal. Deterioro hepático: El efecto del deterioro hepático sobre el clearance de nivolumab fue evaluado por análisis de PK poblacional en pacientes con deterioro hepático leve (bilirrubina total [TB] menor o igual al límite superior del rango normal [ULN] y AST mayor al ULN o TB menor a 1 a 1,5 veces el ULN y cualquier valor de AST; n=92). No se hallaron diferencias clínicamente importantes en el clearance de nivolumab entre pacientes con deterioros hepáticos leves y pacientes con función hepática normal. Nivolumab no ha sido estudiado en pacientes con deterioro hepático moderado (TB mayor a 1,5 a 3 veces el ULN y cualquier valor de AST) o severo (TB mayor a 3 veces el ULN y cualquier valor de AST).
Toxicología.
Carcinogénesis, mutagénesis, disfunción de la fertilidad: No se han llevado a cabo estudios para evaluar el potencial de carcinogenicidad o genotoxicidad de nivolumab. No se han realizado estudios de fertilidad con nivolumab. En estudios de toxicología con dosis repetidas de 1 mes y 3 meses realizados en monos, no hubo efectos notables en los órganos reproductivos masculinos y femeninos; sin embargo, la mayoría de los animales de estos estudios no había alcanzado la madurez sexual. Toxicología y/o farmacología en animales: En modelos de animales, la inhibición de la señalización de PD-1 aumentó la severidad de algunas infecciones e intensificó las respuestas inflamatorias. Los ratones PD-1 knockout infectados con M. tuberculosis exhiben una sobrevida marcadamente menor en comparación con los controles de tipo salvaje, que se correlacionó con un aumento de la proliferación bacteriana y las respuestas inflamatorias en estos animales. Los ratones PD-1 knockout también han demostrado una menor sobrevida luego de la infección con el virus de coriomeningitis linfocítica.
Indicaciones.
Melanoma irresecable o metastásico: OPDIVO® como monoterapia está indicado para el tratamiento de pacientes con melanoma irresecable o metastásico sin mutación BRAF V600 (wild- type). OPDIVO como monoterapia está indicado para el tratamiento de pacientes con melanoma irresecable o metastásico, positivo para la mutación BRAF V600. OPDIVO, en combinación con ipilimumab, está indicado para el tratamiento de pacientes con melanoma irresecable o metastásico. Cáncer de pulmón metastásico de células no pequeñas (NSCLC): OPDIVO está indicado para el tratamiento de pacientes con cáncer de pulmón metastásico de células no pequeñas (NSCLC, por sus siglas en inglés) que muestra progresión durante o después de la quimioterapia basada en platino. Previo a recibir OPDIVO, los pacientes con mutaciones tumorales genómicas de EGFR o ALK deben haber presentado progresión de la enfermedad con una terapia aprobada para estas mutaciones. Carcinoma de células renales (RCC): OPDIVO está indicado para el tratamiento de pacientes con carcinoma avanzado de células renales (RCC, por sus siglas en inglés) que han recibido terapia anti-angiogénica previa. Linfoma de Hodgkin clásico (cHL): OPDIVO está indicado para el tratamiento de pacientes con linfoma de Hodgkin clásico (cHL, por sus siglas en inglés) que ha presentado recidiva o progresión luego del trasplante autólogo de células madre hematopoyéticas (HSCT, por sus siglas en inglés) y tratamiento con brentuximab vedotina post trasplante. Carcinoma de células escamosas de cabeza y cuello (SCCHN): OPDIVO está indicado para el tratamiento de pacientes con carcinoma de células escamosas de cabeza y cuello (SCCHN, por sus siglas en inglés) recurrente o metastásico que han sufrido progresión de la enfermedad durante o luego de una terapia basada en platino. Carcinoma urotelial: OPDIVO está indicado para el tratamiento de pacientes con carcinoma urotelial localmente avanzado o metastásico que: tienen progresión de la enfermedad durante o después de quimioterapia basada en platino, tienen progresión de la enfermedad dentro de los 12 meses del tratamiento neoadyuvante o adyuvante con quimioterapia basada en platino.
Dosificación.
Dosis recomendada para Melanoma: La dosis recomendada de OPDIVO como monoterapia es de 240 mg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. La dosis recomendada de OPDIVO es de 1 mg/kg administrada en forma de infusión intravenosa durante 60 minutos, seguida por ipilimumab el mismo día, cada 3 semanas por 4 dosis. La dosis subsiguiente recomendada de OPDIVO, como monoterapia, es de 240 mg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. L
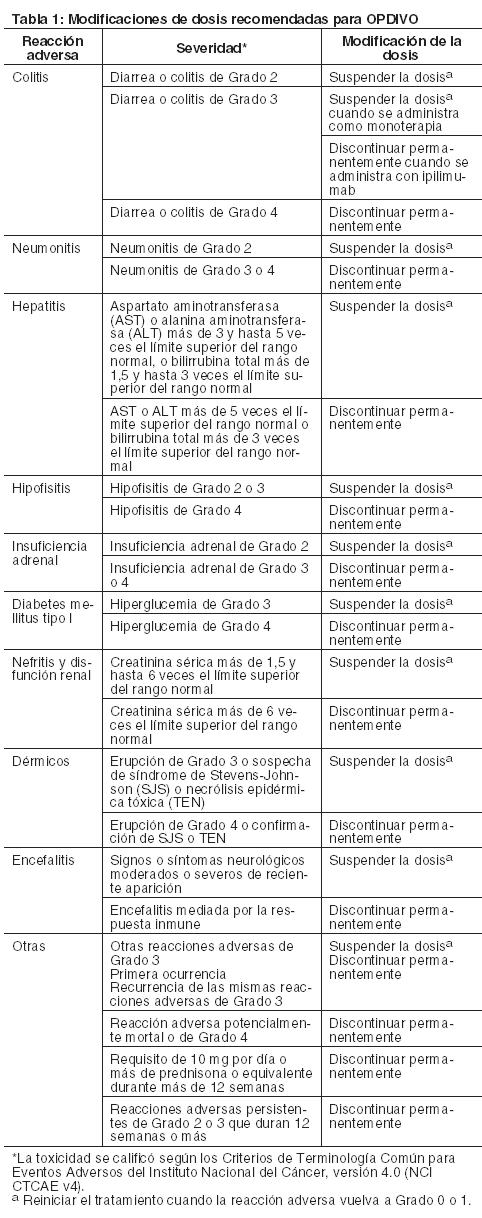
eer el Prospecto completo de Prescripción de ipilimumab antes de iniciar tratamiento. Dosis recomendada para NSCLC: La dosis recomendada de OPDIVO es de 240 mg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. Dosis recomendada para RCC: La dosis recomendada de OPDIVO es de 240 mg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. Dosis recomendada para cHL: La dosis recomendada de OPDIVO es de 3 mg/kg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. Dosis recomendada para SCCHN: La dosis recomendada de OPDIVO es de 3 mg/kg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. Dosis recomendada para carcinoma urotelial: La dosis recomendada de OPDIVO es de 240 mg administrada en forma de infusión intravenosa durante 60 minutos cada 2 semanas, hasta la aparición de progresión de la enfermedad o de una toxicidad inaceptable. Modificaciones de la dosis recomendada: Las recomendaciones para modificar la dosis de OPDIVO se proporcionan en la Tabla 1. Cuando OPDIVO se administra en combinación con ipilimumab, si se suspende OPDIVO, también se debe suspender ipilimumab. No hay modificaciones de dosis recomendadas para hipotiroidismo o hipertiroidismo. Interrumpir o disminuir la velocidad de infusión en pacientes con reacciones a la infusión leves o moderadas. Discontinuar OPDIVO en pacientes con reacciones a la infusión severas o potencialmente mortales.
Preparación y administración: Inspeccionar visualmente la solución del producto farmacológico en busca de partículas y decoloración antes de su administración. OPDIVO es una solución de transparente a opalescente, entre incolora y de color amarillo pálido. Descartar el vial si la solución se presenta turbia, decolorada, o contiene material particulado extraño distinto de algunas partículas proteináceas translúcidas a blancas. No agitar el vial. Preparación: Retirar el volumen requerido de OPDIVO y transferirlo a una bolsa para infusión intravenosa. Diluir OPDIVO con cloruro de sodio al 0,9% para uso inyectable USP, o con dextrosa al 5% para uso inyectable USP, para preparar una infusión con una concentración final de 1 mg/mL a 10 mg/mL. Mezclar la solución diluida invirtiendo el envase suavemente. No agitar. Descartar los viales parcialmente usados o los viales vacíos de OPDIVO. Almacenamiento de la infusión: El producto no contiene conservantes. Luego de su preparación, conservar la infusión de OPDIVO en alguna de las siguientes condiciones: a temperatura ambiente (no mayor a 30°C) durante no más de 4 horas desde el momento de la preparación. Esto incluye el almacenamiento a temperatura ambiente (no mayor a 30°C) de la infusión en el recipiente IV y el tiempo para la administración de la infusión, o en condiciones de refrigeración a 2°C - 8°C durante no más de 24 horas desde el momento en que se prepara la infusión. No congelar. Administración: Administrar la infusión durante 60 minutos a través de una vía intravenosa que contenga un filtro en línea estéril, no pirogénico, de baja unión a proteínas (tamaño de poro de 0,2 micrómetros a 1,2 micrómetros). No coadministrar otros fármacos a través de la misma vía intravenosa. Enjuagar la vía intravenosa al final de la infusión. Cuando se administra en combinación con ipilimumab, infundir OPDIVO primero, seguido por ipilimumab el mismo día. Usar bolsas y filtros para infusión separados para cada infusión. Formas de dosificación y concentraciones: Inyección: Solución de 40 mg/4 mL (10 mg/mL) y 100 mg/10 mL (10 mg/mL) en vial para dosis única.
Contraindicaciones.
OPDIVO está contraindicado en pacientes con hipersensibilidad previamente demostrada a nivolumab o a cualquier componente del producto.
Reacciones adversas.
Las siguientes reacciones adversas se analizan en mayor detalle en otras secciones del prospecto. Neumonitis mediada por la respuesta inmune. Colitis mediada por la respuesta inmune. Hepatitis mediada por la respuesta inmune. Endocrinopatías mediadas por la respuesta inmune. Nefritis y disfunción renal mediadas por la respuesta inmune. Reacciones adversas dérmicas mediadas por la respuesta inmune. Encefalitis mediada por la respuesta inmune. Otras reacciones adversas mediadas por la respuesta inmune. Reacciones a la infusión. Complicaciones del HSCT alogénico tras OPDIVO. Experiencia en estudios clínicos: Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas de los ensayos clínicos de otro fármaco, y pueden no reflejar las tasas observadas en la práctica. Los datos en la sección de Advertencias reflejan la exposición a OPDIVO, como monoterapia, para reacciones adversas clínicamente significativas en 1994 pacientes enrolados en los Ensayos 1 a 8, o en un ensayo de rama única en NSCLC (n=117) en donde se administró OPDIVO como monoterapia. Además, las reacciones adversas clínicamente significativas de OPDIVO administrado con ipilimumab fueron evaluadas en 407 pacientes con melanoma enrolados en el Ensayo 6 (n=313) o en un estudio randomizado de Fase 2 (n=94), en donde se administró OPDIVO con ipilimumab, complementadas por reportes de reacciones adversas mediadas por la respuesta inmune en ensayos clínicos en curso. Los datos descritos a continuación reflejan la exposición a OPDIVO como monoterapia en el Ensayos 1, 4 y 6, y a OPDIVO con ipilimumab en el Ensayo 6, los cuales son ensayos randomizados, con control activo, realizados en pacientes con melanoma irresecable o metastásico. También se describen a continuación los datos de OPDIVO como monoterapia de los Ensayos 2 y 3, que son ensayos randomizados realizados en pacientes con NSCLC metastásico, del Ensayo 5, que es un ensayo randomizado en pacientes con RCC avanzado, de los Ensayos 7 y 8, que son ensayos abiertos, de múltiples cohortes, en pacientes con cHL, del Ensayo 9, un ensayo randomizado en pacientes con SCCHN recurrente o metastásico, y el Ensayo 10, que es un ensayo de rama única en pacientes con carcinoma urotelial. Melanoma irresecable o metastásico: Melanoma metastásico previamente tratado: La seguridad de OPDIVO como monoterapia fue evaluada en el Ensayo 1, un estudio randomizado, abierto, en el cual 370 pacientes con melanoma irresecable o metastásico recibieron OPDIVO 3 mg/kg cada 2 semanas (n=268) o quimioterapia a elección del investigador (n=102), ya sea dacarbazina 1000 mg/m2 cada 3 semanas o la combinación de carboplatino AUC 6 cada 3 semanas más paclitaxel 175 mg/m2 cada 3 semanas. La mediana de la duración de la exposición fue de 5,3 meses (rango: 1 día a 13,8+ meses) en pacientes tratados con OPDIVO y fue de 2 meses (rango: 1 día a 9,6+ meses) en pacientes tratados con quimioterapia. En este ensayo en curso, el 24% de los pacientes recibieron OPDIVO durante más de 6 meses, y el 3% de los pacientes recibieron OPDIVO durante más de 1 año. En el Ensayo 1, los pacientes tenían progresión documentada de la enfermedad luego del tratamiento con ipilimumab y, si eran positivos para la mutación BRAF V600, un inhibidor de BRAF. El ensayo excluyó pacientes con enfermedad autoinmune, reacciones adversas previas de Grado 4 relacionadas con ipilimumab (excepto por endocrinopatías) o reacciones adversas de Grado 3 relacionadas con ipilimumab que no se habían resuelto o que estaban inadecuadamente controladas dentro de las 12 semanas de iniciado el evento, pacientes con una afección que requería tratamiento sistémico crónico con corticosteroides ( > 10 mg diarios de equivalente de prednisona) u otras medicaciones inmunosupresoras, resultado positivo en la prueba de hepatitis B o C, y antecedentes de VIH. Las características de la población del ensayo en el grupo de OPDIVO y el grupo de quimioterapia eran similares: 66% de hombres, mediana de edad 59,5 años, 98% de raza blanca, estado funcional según el Eastern Cooperative Oncology Group (ECOG) en condición basal 0 (59%) o 1 (41%), 74% con enfermedad en estadio M1c, 73% con melanoma cutáneo, 11% con melanoma de mucosa, 73% recibió dos terapias previas o más para la enfermedad avanzada o metastásica, y 18% tenía metástasis cerebral. Había más pacientes en el grupo de OPDIVO con nivel elevado de LDH en condición basal (51% vs. 38%). OPDIVO fue discontinuado por reacciones adversas en el 9% de los pacientes. El 26% de los pacientes que recibieron OPDIVO tuvieron una demora del fármaco debido a una reacción adversa. Se produjeron reacciones adversas serias en el 41% de los pacientes que recibieron OPDIVO. Se registraron reacciones adversas de Grado 3 y 4 en el 42% de los pacientes que recibieron OPDIVO. Las reacciones adversas de Grado 3 y 4 más frecuentes reportadas en 2% a menos del 5% de los pacientes que recibieron OPDIVO fueron dolor abdominal, hiponatremia, aumento de aspartato aminotransferasa y aumento de lipasa. La Tabla 2 resume las reacciones adversas que ocurrieron en al menos el 10% de los pacientes tratados con OPDIVO en Ensayo 1. La reacción adversa más común (reportada en al menos el 20% de los pacientes) fue erupción.
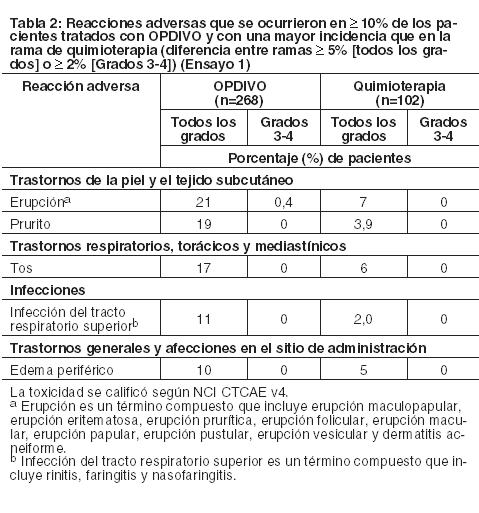
Otras reacciones adversas clínicamente importantes ocurridas en menos del 10% de los pacientes tratados con OPDIVO en el Ensayo 1 fueron las siguientes: Trastornos cardíacos: arritmia ventricular. Trastornos oculares: iridociclitis. Trastornos generales y afecciones en el sitio de administración: reacciones relacionadas con la infusión. Investigaciones: aumento de amilasa, aumento de lipasa. Trastornos del sistema nervioso: mareos, neuropatía periférica y sensorial. Trastornos de la piel y el tejido subcutáneo: dermatitis exfoliativa, eritema multiforme, vitiligo, psoriasis.
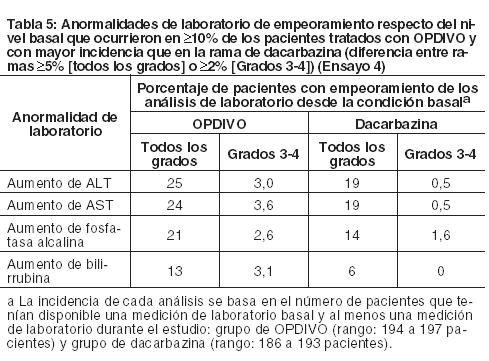
Melanoma metastásico no tratado previamente: Ensayo 4: La seguridad de OPDIVO también fue evaluada en el Ensayo 4, un ensayo randomizado, doble ciego, con control activo, en el cual 411 pacientes con melanoma irresecable o metastásico sin mutación BRAF V600 (wild-type), no tratados previamente, recibieron OPDIVO 3 mg/kg cada 2 semanas (n=206) o dacarbazina 1000 mg/m2 cada 3 semanas (n=205). La mediana de la duración de la exposición fue de 6,5 meses (rango: 1 día a 16,6 meses) en pacientes tratados con OPDIVO. En este ensayo, el 47% de los pacientes recibieron OPDIVO durante más de 6 meses, y el 12% de los pacientes recibieron OPDIVO durante más de 1 año. El ensayo excluyó a pacientes con enfermedad autoinmune y a pacientes que requerían tratamiento sistémico crónico con corticosteroides ( > 10 mg diarios de equivalente de prednisona) u otras medicaciones inmunosupresoras. Las características de la población de ensayo en el grupo de OPDIVO y en el de dacarbazina fueron: 59% de pacientes de sexo masculino, mediana de edad de 65 años, 99,5% de raza blanca, 61% con enfermedad en estadio M1c, 74% con melanoma cutáneo, 11% con melanoma de mucosa, 4% con metástasis cerebral, y 37% con nivel elevado de LDH en condición basal. Hubo más pacientes en el grupo de OPDIVO con un estado funcional ECOG 0 (71% versus 59%). Las reacciones adversas condujeron a la discontinuación permanente de OPDIVO en el 7% de los pacientes y a la interrupción de la dosis en el 26% de los pacientes; ningún tipo único de reacción adversa representó la mayoría de las discontinuaciones de OPDIVO. Se produjeron reacciones adversas serias en el 36% de los pacientes que recibieron OPDIVO. Se produjeron reacciones adversas de Grado 3 y 4 en el 41% de los pacientes que recibieron OPDIVO. Las reacciones adversas de Grado 3 y 4 más frecuentes reportadas en al menos 2% de los pacientes que recibieron OPDIVO fueron aumento de gamma-glutamiltransferasa (3,9%) y diarrea (3,4%). La Tabla 4 sintetiza reacciones adversas seleccionadas que ocurrieron en al menos 10% de los pacientes tratados con OPDIVO. Las reacciones adversas más comunes (reportadas en al menos 20% de los pacientes y con mayor incidencia que en la rama de dacarbazina) fueron fatiga, dolor musculoesquelético, erupción y prurito.
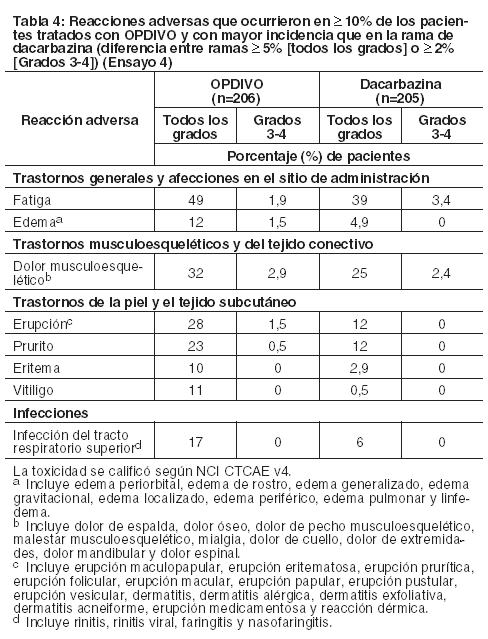
Otras reacciones adversas clínicamente importantes observadas en menos del 10% de los pacientes tratados con OPDIVO en el Ensayo 4 fueron las siguientes: Trastornos del sistema nervioso: neuropatía periférica.
Ensayo 6: La seguridad de OPDIVO, administrado con ipilimumab o como agente único, fue evaluada en el Ensayo 6, un ensayo randomizado (1:1:1), a doble ciego, en el cual 937 pacientes con melanoma irresecable o metastásico no tratados previamente recibieron: OPDIVO 1 mg/kg con ipilimumab 3 mg/kg cada 3 semanas por 4 dosis, seguido por OPDIVO 3 mg/kg como monoterapia cada 2 semanas (rama de OPDIVO más ipilimumab; n=313), OPDIVO 3 mg/kg cada 2 semanas (rama de OPDIVO; n=313), o Ipilimumab 3 mg/kg cada 3 semanas por hasta 4 dosis (rama de ipilimumab; n=311). La mediana de la duración de la exposición a OPDIVO fue de 2,8 meses (rango: 1 día a 18,8 meses) para la rama de OPDIVO más ipilimumab, y de 6,6 meses (rango: 1 día a 17,3 meses) para la rama de OPDIVO. En la rama de OPDIVO más ipilimumab, el 39% estuvo expuesto a OPDIVO durante ≥ 6 meses y el 24% estuvo expuesto durante > 1 año. En la rama de OPDIVO, el 53% estuvo expuesto durante ≥ 6 meses y el 32% durante > 1 año. El Ensayo 6 excluyó a pacientes con enfermedad autoinmune, una afección que requiriera tratamiento sistémico con corticosteroides (más de 10 mg diarios de equivalentes de prednisona) u otra medicación inmunosupresora dentro de los 14 días del inicio de la terapia del estudio, resultado positivo en la prueba de hepatitis B o C, o antecedentes de VIH. Las características de la población de ensayo fueron las siguientes: 65% de sexo masculino, mediana de edad 61 años, 97% de raza blanca, estado funcional ECOG en condición basal 0 (73%) o 1 (27%), 93% con enfermedad en Estadio IV AJCC, 58% con enfermedad en estadio M1c; 36% con nivel elevado de LDH en condición basal, 4% con antecedentes de metástasis cerebral, y 22% habían recibido terapia adyuvante. En el Ensayo 6, las reacciones adversas serias (73% y 37%), las reacciones adversas que condujeron a la discontinuación permanente (43% y 14%) o a la demora de la dosis (55% y 28%), y las reacciones adversas de Grado 3 o 4 (72% y 44%) se produjeron todas con mayor frecuencia en pacientes de la rama de OPDIVO más ipilimumab que en la rama de OPDIVO. Las reacciones adversas serias más frecuentes (≥10%) en la rama de OPDIVO más ipilimumab y en la rama de OPDIVO, respectivamente, fueron diarrea (13% y 2,6%), colitis (10% y 1,6%) y pirexia (10% y 0,6%). Las reacciones adversas más frecuentes que condujeron a la discontinuación de ambos fármacos en la rama de OPDIVO más ipilimumab y de OPDIVO en la rama de OPDIVO, respectivamente, fueron diarrea (8% y 1,9%), colitis (8% y 0,6%), aumento de ALT (4,8% y 1,3%), aumento de AST (4,5% y 0,6%) y neumonitis (1,9% y 0,3%). Las reacciones adversas más comunes (≥ 20%) en la rama de OPDIVO más ipilimumab fueron fatiga, erupción, diarrea, náuseas, pirexia, vómitos y disnea. Las reacciones adversas más comunes (≥ 20%) en la rama de OPDIVO fueron fatiga, erupción, diarrea y náuseas. La Tabla 6 sintetiza la incidencia de reacciones adversas que se produjeron en al menos el 10% de los pacientes de cualquiera de las ramas que contenían OPDIVO en el Ensayo 6.
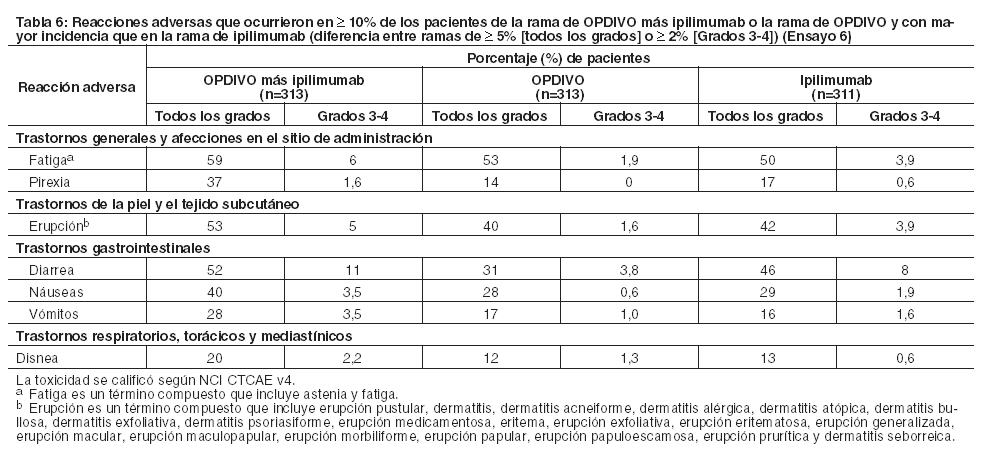
Otras reacciones adversas importantes desde el punto de vista clínico en menos del 10% de los pacientes tratados con OPDIVO con ipilimumab o con OPDIVO como monoterapia en el Ensayo 6 fueron las siguientes: Trastornos gastrointestinales: estomatitis, perforación intestinal. Trastornos de la piel y el tejido subcutáneo: vitiligo. Trastornos musculoesqueléticos y del tejido conectivo: miopatía, síndrome de Sjögren, espondiloartropatía. Trastornos del sistema nervioso: neuritis, parálisis del nervio peroneo.
Cáncer de pulmón de células no pequeñas metastásico: La seguridad de OPDIVO en el NSCLC metastásico fue evaluada en el Ensayo 2, un ensayo multicéntrico, abierto, randomizado, realizado en pacientes con NSCLC escamoso metastásico y progresión de la enfermedad durante o después de un régimen de quimioterapia dual basado en platino previo y en el Ensayo 3, un ensayo randomizado, de diseño abierto, multicéntrico, realizado en pacientes con NSCLC no escamoso metastásico y progresión durante o después de un régimen de quimioterapia dual previo basado en platino. Los pacientes recibieron 3 mg/kg de OPDIVO administrado por vía intravenosa durante 60 minutos cada 2 semanas o docetaxel administrado por vía intravenosa a razón de 75 mg/m2 cada 3 semanas. La mediana de la duración de la terapia en pacientes tratados con OPDIVO en el Ensayo 2 fue de 3,3 meses (rango: 1 día a 21,7+ meses) y en el Ensayo 3 fue de 2,6 meses (rango: 0 a 24,0+ meses). En el Ensayo 2, el 36% de los pacientes recibieron OPDIVO durante al menos 6 meses y el 18% de los pacientes recibieron OPDIVO durante al menos 1 año, y en el Ensayo 3, el 30% de los pacientes recibieron OPDIVO durante más de 6 meses, y el 20% de los pacientes recibieron OPDIVO durante más de 1 año. El Ensayo 2 y el Ensayo 3 excluyeron a pacientes con enfermedad autoinmune activa, afecciones médicas que requirieran inmunosupresión sistémica o enfermedad pulmonar intersticial sintomática. En ambos ensayos, la mediana de la edad de los pacientes tratados con OPDIVO fue de 61 años (rango: 37 a 85); el 38% tenían ≥65 años de edad, el 61% eran de sexo masculino, y el 91% eran de raza blanca. El 10% de los pacientes tenían metástasis cerebral, y su estado funcional ECOG era de 0 (26%) o 1 (74%). OPDIVO fue discontinuado en el 11% de los pacientes, y fue demorado en el 28% de los pacientes por una reacción adversa. Se produjeron reacciones adversas serias en el 46% de los pacientes que recibieron OPDIVO. Las reacciones adversas serias más frecuentes reportadas en al menos 2% de los pacientes que recibieron OPDIVO fueron neumonía, embolia pulmonar, disnea, pirexia, derrame pleural, neumonitis y falla respiratoria. En el Ensayo 3, en la rama de OPDIVO, siete muertes se debieron a infección, incluido un caso de neumonía por Pneumocystis jirovecii, cuatro muertes se debieron a embolia pulmonar, y una muerte se debió a encefalitis límbica. En ambos ensayos, las reacciones adversas más comunes (reportadas en al menos 20% de los pacientes) fueron fatiga, dolor musculoesquelético, tos, disnea y disminución del apetito. La Tabla 8 sintetiza las reacciones adversas seleccionadas que se produjeron con mayor frecuencia en al menos el 10% de los pacientes tratados con OPDIVO.
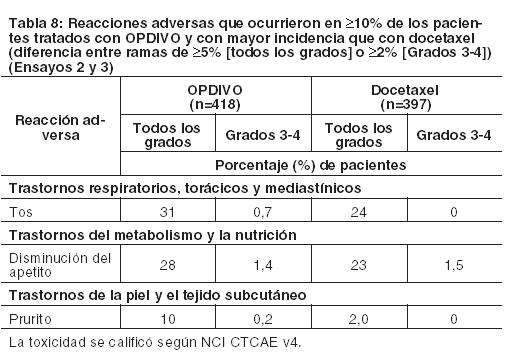
Otras reacciones adversas clínicamente importantes observadas en pacientes tratados con OPDIVO y que se produjeron con una incidencia similar en pacientes tratados con docetaxel y que no se enumeran en otra parte de la sección 6 incluyen: fatiga/astenia (48% de Grado 1-4, 5% de Grado 3-4), dolor musculoesquelético (33%), derrame pleural (4,5%), embolia pulmonar (3,3%).
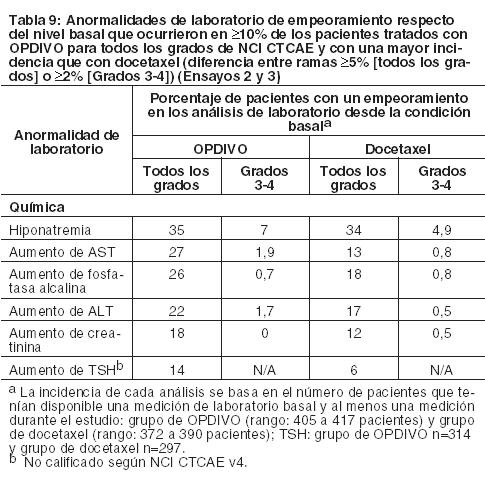
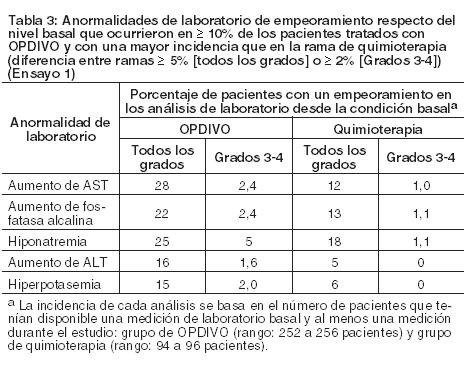
Carcinoma de células renales: La seguridad de OPDIVO fue evaluada en el Ensayo 5, un ensayo randomizado, de diseño abierto, en el cual 803 pacientes con RCC avanzado que habían experimentado progresión de la enfermedad durante o después de al menos un régimen de tratamiento anti-angiogénico recibieron OPDIVO 3 mg/kg cada 2 semanas (n=406) o everolimus 10 mg/kg diariamente (n=397). La mediana de la duración del tratamiento fue de 5,5 meses (rango: 1 día a 29,6+ meses) en pacientes tratados con OPDIVO y de 3,7 meses (rango: 6 días a 25,7+ meses) en pacientes tratados con everolimus. La terapia del estudio fue discontinuada por reacciones adversas en el 16% de los pacientes tratados con OPDIVO y en el 19% de los pacientes tratados con everolimus. El 44% de los pacientes que recibieron OPDIVO tuvieron una demora en la administración de la dosis por una reacción adversa. Se produjeron reacciones adversas serias en el 47% de los pacientes que recibieron OPDIVO. Las reacciones adversas más frecuentes reportadas en al menos el 2% de los pacientes fueron lesión renal aguda, derrame pleural, neumonía, diarrea e hipercalcemia. La tasa de mortalidad durante el tratamiento o dentro de los 30 días posteriores a la última dosis del fármaco del estudio fue del 4,7% en la rama de OPDIVO versus 8,6% en la rama de everolimus. Las reacciones adversas más comunes (reportadas en al menos el 20% de los pacientes) fueron afecciones asténicas, tos, náuseas, erupción, disnea, diarrea, constipación, disminución del apetito, dolor de espalda y artralgia. La Tabla 10 sintetiza las reacciones adversas que se produjeron en más del 15% de los pacientes tratados con OPDIVO.
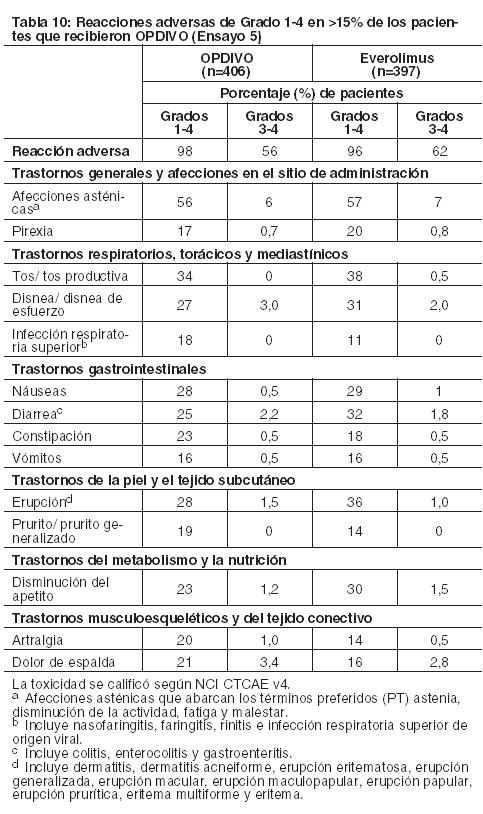
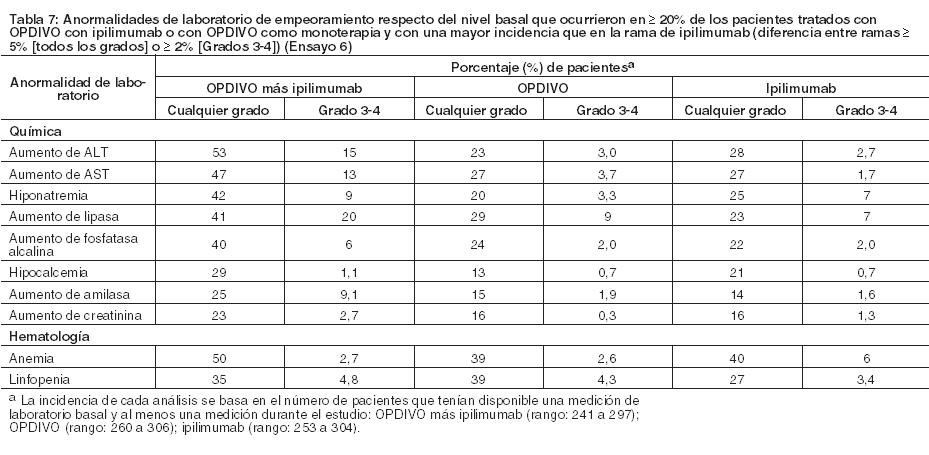
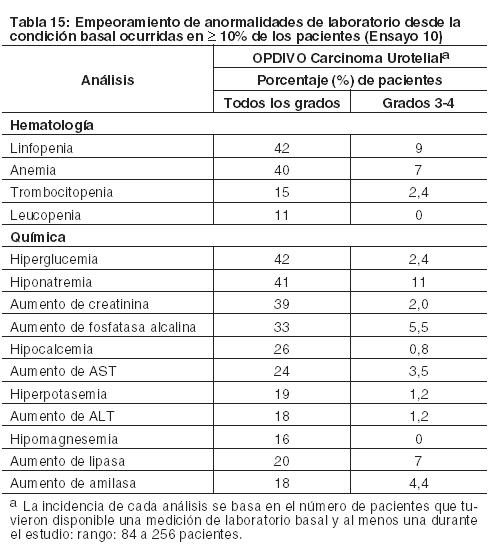
Otras reacciones adversas clínicamente importantes en el Ensayo 5 fueron las siguientes: Trastornos generales y afecciones en el sitio de administración: edema periférico/edema. Trastornos gastrointestinales: dolor/malestar abdominal. Trastornos musculoesqueléticos y del tejido conectivo: dolor de extremidades, dolor musculoesquelético. Trastornos del sistema nerviosos cefalea/migraña, neuropatía periférica. Investigaciones: descenso de peso. Trastornos dérmicos: Eritrodisestesia palmo-plantar. Las anormalidades de laboratorio más comunes que empeoraron en comparación con la condición basal en ≥30% de los pacientes incluyen aumento de creatinina, linfopenia, anemia, aumento de AST, aumento de fosfatasa alcalina, hiponatremia, nivel elevado de triglicéridos e hiperpotasemia. La Tabla 11 sintetiza las anormalidades de laboratorio que se produjeron en más del 15% de los pacientes tratados con OPDIVO.
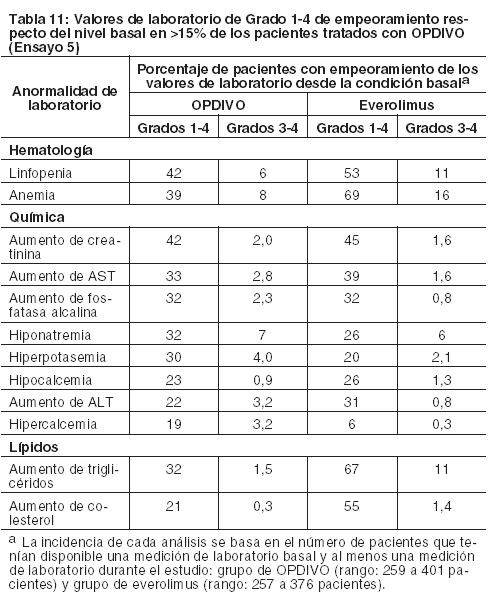
Asimismo, entre los pacientes con TSH menor al ULN en condición basal, una mayor proporción de pacientes experimentaron una elevación de TSH emergente del tratamiento superior al ULN en el grupo de OPDIVO en comparación con el grupo de everolimus (26% y 14%, respectivamente). Linfoma de Hodgkin clásico: La seguridad de OPDIVO 3 mg/kg cada 2 semanas fue evaluada en 263 pacientes adultos con cHL (240 pacientes en el Ensayo 7 y 23 pacientes en el Ensayo 8). El tratamiento pudo continuar hasta la progresión de la enfermedad, el máximo beneficio clínico o una toxicidad inaceptable. La mediana de la edad fue de 34 años (rango: 18 a 72), el 98% de los pacientes habían recibido HSCT autólogo, ninguno había recibido HSCT alogénico, y el 74% había recibido brentuximab vedotina. La mediana del número de regímenes sistémicos previos fue 4 (rango: 1 a 15). Los pacientes recibieron una mediana de 10 dosis (ciclos) de OPDIVO (rango: 1 a 48), con una mediana de la duración de la terapia de 4,8 meses (rango: 0,3 a 24 meses). OPDIVO fue discontinuado debido a reacciones adversas en el 4,2% de los pacientes. El 23% de los pacientes tuvieron una demora de la dosis por una reacción adversa. Se produjeron reacciones adversas serias en el 21% de los pacientes. Las reacciones adversas serias más frecuentes reportadas en al menos el 1% de los pacientes fueron reacciones relacionadas con la infusión, neumonía, derrame pleural, pirexia, erupción y neumonitis. Diez pacientes murieron por causas no relacionadas a la progresión de la enfermedad, incluidos 6 que murieron a raíz de complicaciones del HSCT alogénico. Las reacciones adversas más comunes (reportadas en al menos el 20%) entre todos los pacientes (población de seguridad), fueron fatiga, infección del tracto respiratorio superior, pirexia, diarrea y tos. En el subconjunto de pacientes de la población de eficacia, las reacciones adversas más comunes también incluyeron erupción, dolor músculoesquelético, prurito, náuseas, artralgia y neuropatía periférica. Se produjeron reacciones adversas serias en el 27% de estos pacientes. La Tabla 12 sintetiza las reacciones adversas que se produjeron en al menos el 10% de los pacientes de la población de seguridad (n=263) y la población de eficacia (n=95). Hay una mayor incidencia de reacciones adversas en el subconjunto de pacientes evaluados en eficacia; estos pacientes recibieron una mediana de 17 dosis de OPDIVO y una mediana de 5 regímenes sistémicos previos.
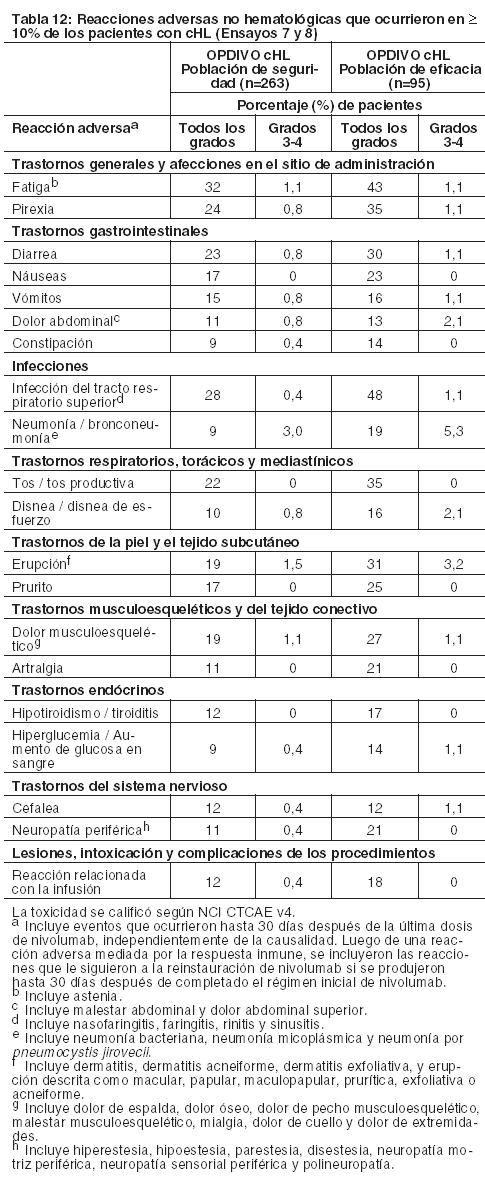
Información adicional sobre reacciones adversas clínicamente importantes:Neumonitis mediada por la respuesta inmune: En los Ensayos 7 y 8, se produjo neumonitis, incluida enfermedad pulmonar intersticial, en el 4,9% (13/263) de los pacientes que recibieron OPDIVO. Se produjo neumonitis mediada por la respuesta inmune en el 3,4% (9/263) de los pacientes que recibieron OPDIVO (un caso de Grado 3 y ocho casos de Grado 2). La mediana del tiempo hasta su presentación fue de 2,2 meses (rango: 1 día a 10,1 meses). Los nueve pacientes recibieron corticosteroides sistémicos, y se observó la resolución en siete de ellos. Un paciente discontinuó permanentemente OPDIVO debido a neumonitis de Grado 2. Se produjo un retraso de la dosis en tres pacientes. Cinco pacientes reiniciaron OPDIVO, de los cuales ninguno presentó recurrencia de la neumonitis. Neuropatía periférica: En los Ensayos 7 y 8, se observó neuropatía periférica en el 11% (30/263) de todos los pacientes que recibieron OPDIVO. Veintidós pacientes (8%) tuvieron neuropatía periférica de nuevo inicio, y cuatro pacientes tuvieron empeoramiento desde la condición basal. Cuatro pacientes más con neuropatía periférica de base (tres de Grado 1 y uno de Grado 2) no empeoraron. Todos los eventos fueron de Grado 1 o 2, excepto por 1 evento de Grado 3 (0,4%). Complicaciones del HSCT alogénico tras OPDIVO:
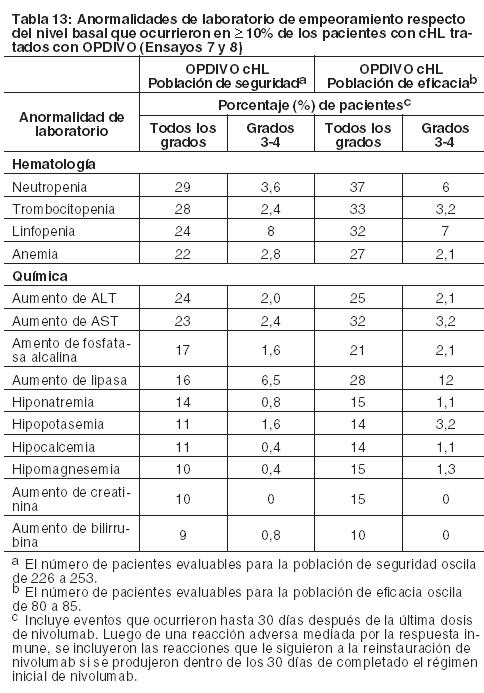
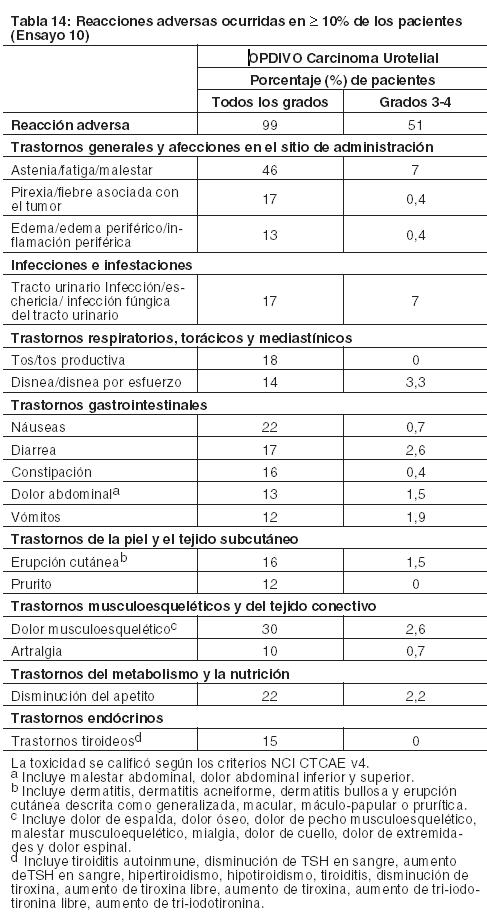
Carcinoma de células escamosas de cabeza y cuello recurrente o metastásico: La seguridad de OPDIVO fue evaluada en el Ensayo 9, un ensayo randomizado, con control activo, abierto, multicéntrico, en pacientes con SCCHN recurrente o metastásico y progresión durante o dentro de los 6 meses después de haber recibido una terapia previa basada en platino. Los pacientes recibieron 3 mg/kg de OPDIVO (n=236) administrado por vía intravenosa (IV) durante 60 minutos cada 2 semanas, o un agente a elección del investigador: cetuximab (n=13), dosis de carga IV de 400 mg/m2 seguida por 250 mg/m2 semanalmente, o metotrexato (n=46) de 40 a 60 mg/m2 semanalmente por vía IV, o docetaxel (n=52) de 30 a 40 mg/m2 semanalmente por vía IV. La mediana de la duración de la exposición a nivolumab fue de 1,9 meses (rango: 1 día a 16,1+ meses) en pacientes tratados con OPDIVO. En este ensayo, el 18% de los pacientes recibieron OPDIVO durante más de 6 meses y el 2,5% de los pacientes recibieron OPDIVO durante más de 1 año. El Ensayo 9 excluyó a pacientes con enfermedad autoinmune activa, afecciones médicas que requirieran inmunosupresión sistémica, o carcinoma recurrente o metastásico de nasofaringe, carcinoma de células escamosas de histología primaria desconocida, de glándulas salivales o de histologías no escamosas (por ejemplo, melanoma de mucosa). La mediana de la edad de todos los pacientes randomizados fue de 60 años (rango: 28 a 83); el 28% de los pacientes del grupo de OPDIVO tenían ≥65 años de edad, y el 37% del grupo comparador tenían ≥65 años de edad; el 83% eran de sexo masculino, y el 83% blancos, el 12% asiáticos y el 4% negros. El estado funcional ECOG en condición basal fue 0 (20%) o 1 (78%); el 45% de los pacientes recibieron una sola línea de terapia sistémica previa, mientras que el 55% restante de los pacientes recibieron dos o más líneas de terapia previas, y el 90% recibió radioterapia previa. OPDIVO fue discontinuado en el 14% de los pacientes y fue demorado en el 24% de los pacientes por una reacción adversa. Se produjeron reacciones adversas serias en el 49% de los pacientes que recibieron OPDIVO. Las reacciones adversas serias más frecuentes reportadas en al menos el 2% de los pacientes que recibieron OPDIVO fueron neumonía, disnea, insuficiencia respiratoria, infección de las vías respiratorias y septicemia. Las reacciones adversas y anormalidades de laboratorio ocurridas en pacientes con SCCHN generalmente fueron similares a las ocurridas en pacientes con melanoma y NSCLC. Las reacciones adversas más comunes ocurridas en ≥ 10% de los pacientes tratados con OPDIVO y con mayor incidencia que con el agente a elección del investigador fueron tos y disnea. Las anormalidades de laboratorio más comunes ocurridas en ≥10% de los pacientes tratados con OPDIVO y con mayor incidencia que con el agente a elección del investigador fueron aumento de fosfatasa alcalina, aumento de amilasa, hipercalcemia, hiperpotasemia y aumento de TSH. Carcinoma urotelial: La seguridad de OPDIVO fue evaluada en el Ensayo 10, un estudio de rama única en el cual 270 pacientes con carcinoma urotelial localmente avanzado o metastásico que tuvieron progresión de la enfermedad durante o después de un esquema de quimioterapia basada en platino o que tuvieron progresión de la enfermedad dentro de los 12 meses del tratamiento neoadyuvante o adyuvante con quimioterapia basada en platino recibieron OPDIVO 3 mg/kg cada 2 semanas hasta la progresión de la enfermedad o una toxicidad inaceptable. La mediana de la duración del tratamiento fue de 3,3 meses (rango: 0 a 13,4+). El 46% de los pacientes tuvieron una demora en la administración del fármaco por una reacción adversa. Catorce pacientes (5,2%) murieron por causas distintas de progresión de la enfermedad. Esto incluye a 4 pacientes (1,5%) que murieron por neumonitis o insuficiencia cardiovascular que se atribuyó al tratamiento con OPDIVO. OPDIVO fue discontinuado por reacciones adversas en el 17% de los pacientes. Se produjeron reacciones adversas serias en el 54% de los pacientes. Las reacciones adversas serias más frecuentes reportadas en al menos el 2% de los pacientes fueron infección del tracto urinario, septicemia, diarrea, obstrucción del intestino delgado y deterioro del estado físico general. Veinticinco pacientes (9%) recibieron una dosis oral de prednisona equivalente a ≥40 mg diarios por una reacción adversa mediada por la respuesta inmune. Las reacciones adversas más comunes (reportadas en al menos el 20% de los pacientes) fueron fatiga, dolor musculoesquelético, náuseas y disminución del apetito. La Tabla 14 sintetiza las reacciones adversas que se produjeron en más del 10% de los pacientes.
Inmunogenicidad: Al igual que con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad. De 2022 pacientes que fueron tratados con OPDIVO como monoterapia 3 mg/kg cada 2 semanas y que fueron evaluables en cuanto a la presencia de anticuerpos anti-nivolumab, 231 pacientes (11,4%) dieron positivo para anticuerpos anti-nivolumab emergentes del tratamiento mediante un ensayo de electroquimioluminiscencia (ECL), y quince pacientes (0,7%) tuvieron anticuerpos neutralizantes contra nivolumab. No hubo evidencia de una alteración en el perfil de farmacocinética ni un aumento de la incidencia de reacciones a la infusión con desarrollo de anticuerpos anti-nivolumab. De 394 pacientes que fueron tratados con OPDIVO con ipilimumab y evaluables en cuanto a la presencia de anticuerpos anti-nivolumab, 149 pacientes (37,8%) dieron positivo en cuanto a anticuerpos anti-nivolumab emergentes del tratamiento mediante un ensayo de ECL, y 18 pacientes (4,6%) tuvieron anticuerpos neutralizantes contra nivolumab. De los 391 pacientes evaluables en cuanto a la presencia de anticuerpos anti-ipilimumab, 33 pacientes (8,4%) dieron positivo para anticuerpos anti-ipilimumab emergentes del tratamiento mediante un ensayo ECL, y un paciente (0,3%) tuvo anticuerpos neutralizantes contra ipilimumab. No hubo evidencia de una mayor incidencia de reacciones a la infusión con desarrollo de anticuerpos anti-nivolumab. La detección de la formación de anticuerpos es altamente dependiente de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos anticuerpos neutralizantes) en un ensayo puede ser influenciada por varios factores, que incluyen la metodología del ensayo, la manipulación de muestras, el cronograma de muestreo, las medicaciones concomitantes y la enfermedad subyacente. Por estos motivos, la comparación de la incidencia de anticuerpos contra OPDIVO con la incidencia de anticuerpos contra otros productos puede ser engañosa.
Advertencias.
Neumonitis mediada por la respuesta inmune: OPDIVO puede causar neumonitis mediada por la respuesta inmune, que se define por requerir el uso de corticosteroides sin una etiología alternativa clara. Se han informado casos mortales. Monitorear a los pacientes en busca de signos y síntomas de neumonitis a través de imágenes radiográficas. Administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona para los casos de neumonitis moderada (Grado 2) o más severa (Grado 3-4), seguido por la reducción gradual de los corticosteroides. Discontinuar OPDIVO en forma permanente en caso de neumonitis severa (Grado 3) o potencialmente mortal (Grado 4), y suspender OPDIVO hasta la resolución en caso de neumonitis moderada (Grado 2). OPDIVO como monoterapia: En pacientes que recibieron OPDIVO como monoterapia, se produjo neumonitis mediada por la respuesta inmune en el 3,1% (61/1994) de los pacientes. La mediana del tiempo hasta el inicio de la neumonitis mediada por la respuesta inmune fue de 3,5 meses (rango: 1 día a 22,3 meses). La neumonitis mediada por la respuesta inmune condujo a la discontinuación permanente de OPDIVO en el 1,1%, y a la suspensión de OPDIVO en el 1,3% de los pacientes. Aproximadamente el 89% de los pacientes con neumonitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 26 días (rango: 1 día a 6 meses). Se produjo la resolución completa de los síntomas luego de la disminución gradual de los corticosteroides en el 67% de los pacientes. Aproximadamente el 8% de los pacientes tuvieron recurrencia de la neumonitis tras la reiniciación de OPDIVO. OPDIVO con ipilimumab: En pacientes que recibieron OPDIVO con ipilimumab, se produjo neumonitis mediada por la respuesta inmune en el 6% (25/407) de los pacientes. La mediana del tiempo hasta el inicio de la neumonitis mediada por la respuesta inmune fue de 1,6 meses (rango: 24 días a 10,1 meses). La neumonitis mediada por la respuesta inmune condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 2,2% y 3,7% de los pacientes, respectivamente. Aproximadamente el 84% de los pacientes con neumonitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 30 días (rango: 5 días a 11,8 meses). Se produjo la resolución completa en el 68% de los pacientes. Aproximadamente el 13% de los pacientes tuvieron recurrencia de la neumonitis tras la reiniciación de OPDIVO con ipilimumab. Colitis mediada por la respuesta inmune: OPDIVO puede causar colitis mediada por la respuesta inmune, definida por la necesidad de usar corticosteroides sin una etiología alternativa clara. Monitorear a los pacientes en busca de signos y síntomas de colitis. Administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona, seguido por la reducción gradual de los corticosteroides en caso de colitis severa (Grado 3) o con potencialmente mortal (Grado 4). Administrar corticosteroides en una dosis de 0,5 a 1 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides en caso de colitis moderada (Grado 2) de más de 5 días de duración; si se produce un empeoramiento o no se registra mejoría a pesar de haber iniciado los corticosteroides, aumentar la dosis a 1 - 2 mg/kg/día de equivalentes de prednisona. Suspender OPDIVO por colitis moderada o severa (Grado 2 o 3). Discontinuar permanentemente OPDIVO en caso de colitis potencialmente mortal (Grado 4) o colitis recurrente tras reiniciar OPDIVO. Cuando se administra en combinación con ipilimumab, suspender OPDIVO e ipilimumab por colitis moderada (Grado 2). Discontinuar permanentemente OPDIVO e ipilimumab en caso de colitis severa o potencialmente mortal (Grado 3 o 4), o por colitis recurrente. OPDIVO como monoterapia: En pacientes que recibieron OPDIVO como monoterapia, se produjo colitis mediada por la respuesta inmune en el 2,9% (58/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 5,3 meses (rango: 2 días a 20,9 meses). La colitis mediada por la respuesta inmune condujo a la discontinuación permanente de OPDIVO en el 0,7% y a la suspensión de OPDIVO en el 1% de los pacientes. Aproximadamente el 91% de los pacientes con colitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 23 días (rango: 1 día a 9,3 meses). Cuatro pacientes requirieron la adición de infliximab a los corticosteroides en altas dosis. Se produjo la resolución completa en el 74% de los pacientes. Aproximadamente el 16% de los pacientes tuvieron recurrencia de colitis tras la reiniciación de OPDIVO. OPDIVO con ipilimumab: En pacientes que recibieron OPDIVO con ipilimumab, se produjo colitis mediada por la respuesta inmune en el 26% (107/407) de los pacientes, incluidos tres casos mortales. La mediana del tiempo hasta el inicio de la colitis mediada por la respuesta inmune fue de 1,6 meses (rango: 3 días a 15,2 meses). La colitis mediada por la respuesta inmune condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 16% y 7% de los pacientes, respectivamente. Aproximadamente el 96% de los pacientes con colitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 1,1 meses (rango: 1 día a 12 meses). Aproximadamente el 23% de los pacientes requirieron la adición de infliximab a los corticosteroides en altas dosis. Se produjo la resolución completa en el 75% de los pacientes. Aproximadamente el 28% de los pacientes tuvieron recurrencia de la colitis tras la reiniciación de OPDIVO con ipilimumab. Hepatitis mediada por la respuesta inmune: OPDIVO puede causar hepatitis mediada por la respuesta inmune, definida por la necesidad de usar corticosteroides sin una etiología alternativa clara. Monitorear a los pacientes por anormalidades en las pruebas hepáticas antes del tratamiento y periódicamente durante el tratamiento. Administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides, en caso de elevación de transaminasas severa (Grado 3) o potencialmente mortal (Grado 4), con o sin elevación concomitante de la bilirrubina total. Administ
rar corticosteroides en una dosis de 0,5 a 1 mg/kg/día de equivalentes de prednisona en caso de elevación de transaminasas moderada (Grado 2). Suspender OPDIVO en caso de hepatitis mediada por la respuesta inmune moderada (Grado 2) y discontinuar permanentemente OPDIVO en casos severos (Grado 3) o con riesgo de muerte (Grado 4). OPDIVO como monoterapia: En pacientes que recibieron OPDIVO como monoterapia, se produjo hepatitis mediada por la respuesta inmune en el 1,8% (35/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 3,3 meses (rango: 6 días a 9 meses). La hepatitis mediada por la respuesta inmune condujo a la discontinuación permanente de OPDIVO en el 0,7% y a la suspensión de OPDIVO en el 1% de los pacientes. Todos los pacientes con hepatitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona) durante una mediana de 23 días (rango: 1 día a 2 meses). Dos pacientes requirieron la adición de ácido micofenólico a los corticosteroides en altas dosis. Se produjo la resolución completa en el 74% de los pacientes. Aproximadamente el 29% de los pacientes tuvieron recurrencia de la hepatitis tras la reiniciación de OPDIVO. OPDIVO con ipilimumab: En pacientes que recibieron OPDIVO con ipilimumab, se produjo hepatitis mediada por la respuesta inmune en el 13% (51/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,1 meses (rango: 15 días a 11 meses). La hepatitis mediada por la respuesta inmune condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 6% y el 5% de los pacientes, respectivamente. Aproximadamente el 92% de los pacientes con hepatitis recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 1,1 meses (rango: 1 día a 13,2 meses). Se produjo la resolución completa en el 75% de los pacientes. Aproximadamente el 11% de los pacientes tuvieron recurrencia de la hepatitis tras la reiniciación de OPDIVO con ipilimumab. Endocrinopatías mediadas por la respuesta inmune: Hipofisitis: OPDIVO puede causar hipofisitis mediada por la respuesta inmune. Monitorear a los pacientes en busca de signos y síntomas de hipofisitis. Administrar terapia de reemplazo hormonal, según esté clínicamente indicado, y corticosteroides en una dosis de 1 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides, en caso de hipofisitis moderada (Grado 2) o mayor. Suspender OPDIVO por hipofisitis moderada (Grado 2) o severa (Grado 3). Discontinuar permanentemente OPDIVO por hipofisitis potencialmente mortal (Grado 4). En pacientes que recibieron OPDIVO como monoterapia, se produjo hipofisitis en el 0,6% (12/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 4,9 meses (rango: 1,4 a 11 meses). La hipofisitis condujo a la discontinuación permanente de OPDIVO en el 0,1% y a la suspensión de OPDIVO en el 0,2% de los pacientes. Aproximadamente el 67% de los pacientes con hipofisitis recibieron terapia de reemplazo hormonal, y el 33% recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 14 días (rango: 5 a 26 días). En pacientes que recibieron OPDIVO con ipilimumab, se produjo hipofisitis en el 9% (36/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,7 meses (rango: 27 días a 5,5 meses). La hipofisitis condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 1,0% y el 3,9% de los pacientes, respectivamente. Aproximadamente el 75% de los pacientes con hipofisitis recibieron terapia de reemplazo hormonal, y el 56% recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 19 días (rango: 1 día a 2,0 meses). Insuficiencia adrenal: OPDIVO puede causar insuficiencia adrenal mediada por la respuesta inmune. Monitorear a los pacientes en busca de signos y síntomas de insuficiencia adrenal. Administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides, en caso de insuficiencia adrenal severa (Grado 3) o potencialmente mortal (Grado 4). Suspender OPDIVO en caso de insuficiencia adrenal moderada (Grado 2), y discontinuar permanentemente OPDIVO en caso de insuficiencia adrenal severa (Grado 3) o potencialmente mortal (Grado 4). En pacientes que recibieron OPDIVO como monoterapia, se produjo insuficiencia adrenal en el 1% (20/1994) de los pacientes, y la mediana del tiempo hasta el inicio fue de 4,3 meses (rango: 15 días a 21 meses). La insuficiencia adrenal condujo a la discontinuación permanente de OPDIVO en el 0,1% y a la suspensión de OPDIVO en el 0,5% de los pacientes. Aproximadamente el 85% de los pacientes con insuficiencia adrenal recibieron terapia de reemplazo hormonal, y el 25% recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 11 días (rango: 1 día a 1 mes). En pacientes que recibieron OPDIVO con ipilimumab, se produjo insuficiencia adrenal en el 5% (21/407) de los pacientes, y la mediana del tiempo hasta el inicio fue de 3,0 meses (rango: 21 días a 9,4 meses). La insuficiencia adrenal condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 0,5% y el 1,7% de los pacientes, respectivamente. Aproximadamente el 57% de los pacientes con insuficiencia adrenal recibieron terapia de reemplazo hormonal, y el 33% recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 9 días (rango: 1 día a 2,7 meses). Hipotiroidismo e hipertiroidismo: OPDIVO puede causar trastornos tiroideos autoinmunes. Monitorear la función tiroidea antes y periódicamente durante el tratamiento con OPDIVO. Administrar terapia de reemplazo hormonal en caso de hipotiroidismo. Iniciar tratamiento médico para el control del hipertiroidismo. No hay ajustes de dosis recomendados de OPDIVO para hipotiroidismo o hipertiroidismo. En pacientes que recibieron OPDIVO como monoterapia, se produjo hipotiroidismo o tiroiditis que condujo a hipotiroidismo en el 9% (171/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,9 meses (rango: 1 día a 16,6 meses). Aproximadamente el 79% de los pacientes con hipotiroidismo recibieron levotiroxina, y el 4% también requirieron corticosteroides. Se produjo la resolución en el 35% de los pacientes. Se produjo hipertiroidismo en el 2,7% (54/1994) de los pacientes que recibieron OPDIVO como monoterapia; la mediana del tiempo hasta el inicio fue de 1,5 meses (rango: 1 día a 14,2 meses). Aproximadamente el 26% de los pacientes con hipertiroidismo recibieron metimazol, el 9% recibieron carbimazol, el 4% recibieron propiltiouracilo, y el 9% recibieron corticosteroides. Se produjo la resolución en el 76% de los pacientes. En pacientes que recibieron OPDIVO con ipilimumab, se produjo hipotiroidismo o tiroiditis que condujo a hipotiroidismo en el 22% (89/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,1 meses (rango: 1 día a 10,1 meses). Aproximadamente el 73% de los pacientes con hipotiroidismo o tiroiditis recibieron levotiroxina. Se produjo la resolución en el 45% de los pacientes. Se produjo hipertiroidismo en el 8% (34/407) de los pacientes que recibieron OPDIVO con ipilimumab: la mediana del tiempo hasta el inicio fue de 23 días (rango: 3 días a 3,7 meses). Aproximadamente el 29% de los pacientes con hipertiroidismo recibieron metimazol, y el 24% recibieron carbimazol. Se produjo la resolución en el 94% de los pacientes. Diabetes mellitus tipo 1: OPDIVO puede causar diabetes mellitus tipo 1. Monitorear a los pacientes para detectar la aparición de hiperglucemia. Suspender OPDIVO en caso de hiperglucemia severa (Grado 3) hasta alcanzar el control metabólico. Discontinuar OPDIVO en forma permanente en caso de hiperglucemia con riesgo de muerte (Grado 4). En pacientes que recibieron OPDIVO como monoterapia, se produjo diabetes en el 0,9% (17/1994) de los pacientes, incluidos dos casos de cetoacidosis diabética. La mediana del tiempo hasta el inicio fue de 4,4 meses (rango: 15 días a 22 meses). En pacientes que recibieron OPDIVO con ipilimumab, se produjo diabetes en el 1,5% (6/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,5 meses (rango: 1,3 a 4,4 meses). OPDIVO con ipilimumab se suspendió en un paciente y se discontinuó permanentemente en un segundo paciente que desarrolló diabetes. Nefritis y disfunción renal mediadas por la respuesta inmune: OPDIVO puede causar nefritis mediada por la respuesta inmune, definida como disfunción renal o aumento de creatinina ≥ Grado 2, requisito de corticosteroides y ausencia de una etiología alternativa clara. Monitorear a los pacientes para detectar una elevación de la creatinina sérica antes y periódicamente durante el tratamiento. Administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides en caso de aumento de creatinina sérica potencialmente mortal (Grado 4). Administrar corticosteroides en una dosis de 0,5 a 1 mg/kg/día de equivalentes de prednisona en caso de aumento de creatinina sérica moderado (Grado 2) o severo (Grado 3); si el cuadro empeora o no se produce una mejoría, aumentar la dosis de corticosteroides a 1 - 2 mg/kg/día de equivalentes de prednisona. Suspender OPDIVO en caso de aumento de creatinina sérica moderado (Grado 2) o severo (Grado 3). Discontinuar permanentemente OPDIVO en caso de aumento de creatinina sérica potencialmente mortal (Grado 4). OPDIVO como monoterapia: En pacientes que recibieron OPDIVO como monoterapia, se produjo nefritis y disfunción renal mediadas por la respuesta inmune en el 1,2% (23/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 4,6 meses (rango: 23 días a 12,3 meses). La nefritis y disfunción renal mediadas por la respuesta inmune condujeron a la discontinuación permanente de OPDIVO en el 0,3% y a la suspensión de OPDIVO en el 0,8% de los pacientes. Todos los pacientes recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 21 días (rango: 1 día a 15,4 meses). Se produjo la resolución completa en el 48% de los pacientes. Ningún paciente presentó recurrencia de nefritis o disfunción renal tras la reiniciación de OPDIVO. OPDIVO con ipilimumab: En pacientes que recibieron OPDIVO con ipilimumab, se produjo nefritis y disfunción renal mediadas por la respuesta inmune en el 2,2% (9/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,7 meses (rango: 9 días a 7,9 meses). La nefritis y disfunción renal mediadas por la respuesta inmune condujeron a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 0,7% y el 0,5% de los pacientes, respectivamente. Aproximadamente el 67% de los pacientes recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 13,5 días (rango: 1 día a 1,1 meses). Se produjo la resolución completa en todos los pacientes. Dos pacientes reiniciaron OPDIVO con ipilimumab, sin recurrencia de la nefritis o disfunción renal. Reacciones adversas dérmicas mediadas por la respuesta inmune: OPDIVO puede causar erupción mediada por la respuesta inmune, incluido síndrome de Stevens-Johnson (SJS) y necrólisis epidérmica tóxica (TEN), algunos casos con desenlace mortal. En caso de signos o síntomas de SJS o TEN, suspender OPDIVO y remitir al paciente para recibir atención especializada para su evaluación y tratamiento. Si se confirma SJS o TEN, discontinuar OPDIVO en forma permanente. En caso de erupción mediada por la respuesta inmune, administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona, seguido por la disminución gradual de los corticosteroides, en caso de erupción severa (Grado 3) o potencialmente mortal (Grado 4). Suspender OPDIVO en caso de erupción severa (Grado 3) y discontinuar permanentemente OPDIVO en caso de erupción potencialmente mortal (Grado 4). OPDIVO como monoterapia: En pacientes que recibieron OPDIVO como monoterapia, se produjo erupción mediada por la respuesta inmune en el 9% (171/1994) de los pacientes; la mediana del tiempo hasta el inicio fue de 2,8 meses (rango: < 1 día a 25,8 meses). La erupción mediada por la respuesta inmune condujo a la discontinuación permanente de OPDIVO en el 0,3% y a la suspensión de OPDIVO en el 0,8% de los pacientes. Aproximadamente el 16% de los pacientes con erupción recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 12 días (rango: 1 día a 8,9 meses), y el 85% recibieron corticosteroides tópicos. Se produjo la resolución completa en el 48% de los pacientes. Se produjo la recurrencia de la erupción en el 1,4% de los pacientes que reiniciaron OPDIVO tras la resolución de la erupción. OPDIVO con ipilimumab: En pacientes que recibieron OPDIVO con ipilimumab, se produjo erupción mediada por la respuesta inmune en el 22,6% (92/407) de los pacientes; la mediana del tiempo hasta el inicio fue de 18 días (rango: 1 día a 9,7 meses). La erupción mediada por la respuesta inmune condujo a la discontinuación permanente o a la suspensión de OPDIVO con ipilimumab en el 0,5% y el 3,9% de los pacientes, respectivamente. Aproximadamente el 17% de los pacientes con erupción recibieron altas dosis de corticosteroides (al menos 40 mg de equivalentes de prednisona por día) durante una mediana de 14 días (rango: 2 días a 4,7 meses). Se produjo la resolución completa en el 47% de los pacientes. Aproximadamente el 6% de los pacientes que reiniciaron OPDIVO e ipilimumab tras la resolución presentaron recurrencia de la erupción. Encefalitis mediada por la respuesta inmune: OPDIVO puede causar encefalitis mediada por la respuesta inmune, sin una etiología alternativa clara. La evaluación de pacientes con síntomas neurológicos puede incluir, entre otras cosas, consulta con un neurólogo, estudio por resonancia magnética del cerebro y punción lumbar. Suspender OPDIVO en pacientes con signos o síntomas neurológicos de inicio reciente moderados a severos, y evaluar para descartar causas infecciosas u otras causas de deterioro neurológico moderado a severo. Si se descartan otras etiologías, administrar corticosteroides en una dosis de 1 a 2 mg/kg/día de equivalentes de prednisona para pacientes con encefalitis mediada por la respuesta inmune, seguido por la disminución gradual de los corticosteroides. Discontinuar permanentemente OPDIVO por encefalitis mediada por la respuesta inmune. OPDIVO como monoterapia: En los pacientes que recibieron OPDIVO como monoterapia, se produjo encefalitis en el 0,2% (3/1994). Se produjo encefalitis límbica fatal en un paciente luego de 7,2 meses de exposición a pesar de la discontinuación de OPDIVO y la administración de corticosteroides. En los otros dos pacientes, se produjo encefalitis post-HSCT alogénico. OPDIVO con ipilimumab: Se produjo encefalitis en un paciente que recibió OPDIVO con ipilimumab (0,2%) luego de 1,7 meses de exposición. Otras reacciones adversas mediadas por la respuesta inmune: OPDIVO puede causar otras reacciones adversas mediadas por la respuesta inmune clínicamente significativas. Pueden ocurrir reacciones adversas mediadas por la respuesta inmune luego de la discontinuación de la terapia con OPDIVO. Para cualquier presunta reacción adversa mediada por la respuesta inmune, excluir otras causas. En función de la severidad de la reacción adversa, discontinuar permanentemente o suspender OPDIVO, administrar corticosteroides en altas dosis y, si corresponde, iniciar terapia de reemplazo hormonal. Tras la mejoría hasta alcanzar el Grado 1 o menor, disminuir los corticosteroides gradualmente y continuar con dicha disminución durante al menos 1 mes. Considerar reiniciar OPDIVO luego de completar la disminución gradual de los corticosteroides, según la severidad del evento. En los ensayos clínicos de OPDIVO administrado como monoterapia o en combinación con ipilimumab, se produjeron las siguientes reacciones adversas mediadas por la respuesta inmune, clínicamente significativas en menos del 1,0% de los pacientes que recibieron OPDIVO: uveítis, iritis, pancreatitis, parálisis facial y del nervio abducens, desmielinización, polimialgia reumática, neuropatía autoinmune, síndrome de Guillain-Barré, hipopituitarismo, síndrome de respuesta inflamatoria sistémica, gastritis, duodenitis, sarcoidosis, linfadenitis necrotizante histiocítica (linfadenitis de Kikuchi), miositis, miocarditis, rabdomiólisis, disfunción motriz, vasculitis y síndrome miasténico. Reacciones a la infusión: OPDIVO puede causar reacciones severas a la infusión, que se han reportado en menos del 1,0% de los pacientes en los ensayos clínicos. Discontinuar OPDIVO en pacientes con reacciones a la infusión severas o potencialmente mortales. Interrumpir o demorar la velocidad de infusión en pacientes con reacciones a la infusión leves o moderadas. OPDIVO como monoterapia: En los pacientes que recibieron OPDIVO como monoterapia, se produjeron reacciones relacionadas con la infusión en el 6,4% (127/1994) de los pacientes. OPDIVO con ipilimumab: En los pacientes que recibieron OPDIVO con ipilimumab, se produjeron reacciones relacionadas con la infusión en el 2,5% (10/407) de los pacientes. Complicaciones del hsct alogénico tras OPDIVO: Se produjeron complicaciones, incluidos eventos fatales, en pacientes que recibieron HSCT alogénico tras recibir OPDIVO. Se evaluaron los resultados en 17 pacientes de los Ensayos 8 y 9 que fueron sometidos a HSCT alogénico tras discontinuar OPDIVO (15 con condicionamiento de intensidad reducida y 2 con acondicionamiento mieloablativo). La mediana de la edad al momento del HSCT fue de 33 (rango: 18 a 56), y se había administrado una mediana de 9 dosis de OPDIVO (rango: 4 a 16). Seis de 17 pacientes (35%) murieron a raíz de complicaciones del HSCT alogénico después de recibir OPDIVO. Cinco muertes se produjeron en el contexto de enfermedad de injerto versus huésped (GVHD) severa o refractaria. Se reportó GVHD aguda de Grado 3 o mayor en 5/17 pacientes (29%). Se reportó GVHD hiperaguda -definida como GVHD ocurrida dentro de los 14 días luego de la infusión de células madre- en 2 pacientes (20%). Se reportó síndrome febril que requirió esteroides, sin una causa infecciosa identificada, en seis pacientes (35%) dentro de las primeras 6 semanas post-trasplante, con cinco pacientes que respondieron a los esteroides. Se reportaron dos casos de encefalitis: un caso de encefalitis linfocítica de Grado 3 sin una causa infecciosa identificada, que se produjo y se resolvió con esteroides, y un caso de encefalitis presuntamente de origen viral de Grado 3 que se resolvió con tratamiento antiviral. Se produjo enfermedad veno-oclusiva (VOD) hepática en un paciente, quien recibió HSCT alogénico con condicionamiento de intensidad reducida, y murió por GVHD y falla multi-orgánica. Otros casos de VOD hepática tras el HSCT alogénico con condicionamiento de intensidad reducida también se han reportado en pacientes con linfoma que recibieron un anticuerpo bloqueador del receptor de PD-1 antes del trasplante. También se han reportado casos de GVHD hiperaguda fatal. Estas complicaciones podrían ocurrir, a pesar de la terapia interviniente, entre el bloqueo de PD-1 y el HSCT alogénico. Seguir a los pacientes de cerca para obtener evidencia temprana de complicaciones relacionadas con el trasplante, tales como GVHD hiperaguda, GVHD aguda severa (Grado 3 a 4), síndrome febril que requiere esteroides, VOD hepática, y otras reacciones adversas mediadas por la respuesta inmune, e intervenir prontamente. Toxicidad embriofetal: Sobre la base de su mecanismo de acción y los datos de estudios en animales, OPDIVO puede causar daño fetal cuando se administra a una mujer embarazada. En los estudios de reproducción en animales, la administración de nivolumab a monos cynomolgus desde el comienzo de la organogénesis hasta el parto dio como resultado un aumento de los abortos y las muertes prematuras de la cría. Advertir a las mujeres embarazadas sobre el potencial riesgo para el feto. Aconsejar a las mujeres en edad fértil que usen un método anticonceptivo efectivo durante el tratamiento con un régimen que contiene OPDIVO y durante al menos 5 meses después de la última dosis de OPDIVO.
Interacciones.
No se han realizado estudios farmacocinéticos formales de interacciones medicamentosas con OPDIVO. Uso en poblaciones específicas. Embarazo: Resumen del riesgo: Sobre la base de su mecanismo de acción y los datos de estudios realizados en animales, OPDIVO puede causar daño fetal cuando es administrado a una mujer embarazada. En los estudios de reproducción animal, la administración de nivolumab a monos cynomolgus desde el inicio de la organogénesis hasta el parto dio como resultado un aumento de los abortos y las muertes prematuras de la cría. Se sabe que la IgG4 humana atraviesa la barrera placentaria, y el nivolumab es una inmunoglobulina G4 (IgG4); por lo tanto, nivolumab tiene el potencial de ser transmitido de la madre al feto en desarrollo. Los efectos de OPDIVO probablemente sean mayores durante el segundo y el tercer trimestre del embarazo. No se dispone de datos en humanos que informen sobre el riesgo asociado con el fármaco. Advertir a las mujeres en edad fértil sobre el riesgo potencial para el feto. Se desconoce el riesgo de referencia de defectos graves del nacimiento y aborto espontáneo para la población indicada; sin embargo, el riesgo de referencia en la población general de EE.UU. de defectos graves del nacimiento es del 2% a 4% y de aborto espontáneo es del 15% a 20% de los embarazos clínicamente reconocidos. Datos: Datos en animales: Una función central de la vía PD-1/PD-L1 es preservar el embarazo, manteniendo la tolerancia inmune materna al feto. Se ha demostrado en modelos murinos de embarazo que el bloqueo de la señalización de PD-L1 altera la tolerancia al feto y aumenta los casos de pérdida del feto. Los efectos de nivolumab sobre el desarrollo prenatal y postnatal fueron evaluados en monos que recibieron nivolumab dos veces por semana desde el inicio de la organogénesis hasta el parto, a niveles de exposición entre 9 y 42 veces mayores que aquellos observados con la dosis clínica de 3 mg/kg de nivolumab (sobre la base del AUC). La administración de nivolumab dio como resultado un aumento no relacionado con la dosis de los abortos espontáneos y un aumento de las muertes neonatales. Sobre la base de su mecanismo de acción, la exposición fetal a nivolumab puede aumentar el riesgo de desarrollar trastornos mediados por la respuesta inmune o de alterar la respuesta inmune normal, y se han informado trastornos mediados por la respuesta inmune en ratones PD-1 knockout. En las crías sobrevivientes de monos cynomolgus tratados con nivolumab (18 de 32, en comparación con 11 de 16 crías expuestas al vehículo), no hubo malformaciones evidentes ni efectos sobre los parámetros de neuroconducta, inmunológicos o de patología clínica durante el período postnatal de 6 meses. Mujeres en período de lactancia: Resumen del riesgo: Se desconoce si OPDIVO está presente en la leche humana. Dado que muchos fármacos, incluidos los anticuerpos, se excretan en la leche humana y debido al potencial de reacciones adversas serias en los lactantes a raíz de OPDIVO, se debe advertir a las mujeres que discontinúen la lactancia durante el tratamiento con OPDIVO. Hombres y mujeres en edad fértil: Anticoncepción: En función de su mecanismo de acción, OPDIVO puede causar daño fetal cuando es administrado a una mujer embarazada. Indicar a las mujeres en edad fértil que deben usar un método anticonceptivo efectivo durante el tratamiento con OPDIVO y durante al menos 5 meses luego de la última dosis de OPDIVO. Uso pediátrico: No se ha establecido la seguridad y la efectividad de OPDIVO en pacientes pediátricos. Uso geriátrico: De los 1359 pacientes randomizados para recibir OPDIVO como monoterapia en los Ensayos 2 a 6, el 39% tenía 65 años de edad o más, y el 9% tenía 75 años o más. No se reportaron diferencias generales en la seguridad ni la efectividad entre pacientes geriátricos y pacientes más jóvenes. En el Ensayo 10 (carcinoma urotelial), el 55% de los pacientes tenía 65 años de edad o más, y el 14% tenía 75 años o más. No se reportaron diferencias generales en la seguridad ni la efectividad entre pacientes geriátricos y pacientes más jóvenes. Los Ensayos 1, 7, 8 y 9 no incluyeron suficiente cantidad de pacientes de 65 años de edad o más para determinar si responden de manera diferente a los pacientes más jóvenes. De los 314 pacientes randomizados para recibir OPDIVO administrado con ipilimumab en el Ensayo 6, el 41% tenía 65 años de edad o más, y el 11% tenía 75 años de edad o más. No se reportaron diferencias generales en la seguridad ni la efectividad entre pacientes geriátricos y pacientes más jóvenes. Insuficiencia renal: Sobre la base de un análisis de farmacocinética poblacional, no se recomienda ningún ajuste de dosis en pacientes con deterioro renal. Insuficiencia hepática: Sobre la base de un análisis de farmacocinética poblacional, no se recomienda ningún ajuste de dosis en pacientes con deterioro hepático leve. OPDIVO no ha sido estudiado en pacientes con deterioro hepático moderado o severo.
Conservación.
Conservar OPDIVO en condiciones de refrigeración entre 2°C - 8°C. Proteger OPDIVO de la luz conservándolo en su envase original hasta el momento de usarlo. No congelar ni agitar.
Sobredosificación.
No se cuenta con información sobre la sobredosis de OPDIVO. Válido para Argentina: Ante la eventualidad de una sobredosis, concurrir al Hospital más cercano o comunicarse con los Centros de Toxicología: Hospital de Pediatría Ricardo Gutiérrez: (011) 4962-6666/2247. Hospital A. Posadas: (011) 4654-6648/4658-7777.
Información al paciente.
Aconsejar al paciente que lea el Prospecto de Información al paciente incluido en el estuche. Informar a los pacientes sobre el riesgo de reacciones adversas mediadas por la respuesta inmune que pueden requerir tratamiento con corticosteroides y la suspensión o discontinuación de OPDIVO, las cuales incluyen: Neumonitis: Indicar a los pacientes que deben comunicarse de inmediato con su médico por cualquier cuadro nuevo o empeoramiento de tos, dolor de pecho o falta de aliento. Colitis: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de diarrea o dolor abdominal severo. Hepatitis: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de ictericia, náuseas o vómitos severos, dolor en el cuadrante derecho del abdomen, letargo, o formación fácil de hematomas o hemorragias. Endocrinopatías: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de signos o síntomas de hipofisitis, insuficiencia adrenal, hipotiroidismo, hipertiroidismo y diabetes mellitus. Nefritis y disfunción renal: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de signos o síntomas de nefritis, que incluyen disminución de la producción de orina, sangre en la orina, hinchazón de tobillos, pérdida del apetito, y cualquier otro síntoma de disfunción renal. Reacciones adversas dérmicas: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de erupción. Encefalitis: Indicar a los pacientes que deben comunicarse de inmediato con su médico en caso de signos o síntomas neurológicos de encefalitis. Reacciones a la infusión: Advertir a los pacientes sobre el potencial riesgo de reacciones a la infusión. Complicaciones del HSCT alogénico tras OPDIVO: Advertir a los pacientes sobre el potencial riesgo de complicaciones post-trasplante. Mujeres en edad fértil: Advertir a las mujeres en edad fértil sobre el potencial riesgo para el feto y que deben informar a su médico en caso de embarazo o sospecha de embarazo. Indicar a las mujeres en edad fértil que deben usar un método anticonceptivo efectivo durante el tratamiento con OPDIVO y durante al menos 5 meses luego de la última dosis de OPDIVO. Lactancia: Advertir a las mujeres que no deben amamantar mientras toman OPDIVO.
Presentación.
OPDIVO® (nivolumab) se presenta de la siguiente forma: Contenidos del envase: 40 mg/4 mL en vial de dosis única. 100 mg/10 mL en vial de dosis única.
Revisión.
Disp. N° 6551-17. Fecha de la última revisión: 14 de Junio de 2017.

